기술동향
포유류 배아의 자기 조직화 원리
- 등록일2021-09-15
- 조회수4521
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2021-09-15
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#포유류 배아#자기 조직화 원리
- 첨부파일
포유류 배아의 자기 조직화 원리
◈목차
2. 기하학적 제약을 통한 계통 할당
3. 조절 피드백을 통한 계통 정체성 자기 강화
4. 자가 조절 회로와 상호 억제
5. 생화학적 신호 모듈간 피드백
6. 세포 자살 매개 세포 제거를 통한 정확한 패턴화
7. 세포의 이질성을 통한 계통 패턴화
8. 배아 줄기 세포를 이용한 시험관 내 배반포 형성 재현
9. 결론 및 전망
◈요약문
배아 발생의 초기 과정은 보존되고 자기 조직화된 과정이다. 포유류 배아에서 자기 조직화의 잠재력은 이들의 독보적인 발달 가소성으로 나타나며, 실험적 교란에도 불구하고 바르게 패턴화된 배아가 발생하도록 한다. 이렇게 조절되는 발달 과정을 가능하게 하는 기전은 오랜 기간 연구 대상이었다. 이 리뷰에서 우리는 포유류 초기 배아의 조절 특성의 이면에 있는 자기 조직화 원리에 대한 이해를 요약할 것이다. 우리는 기하학적 제약, 기계적 및 생화학적 인자간 피드백, 그리고 세포의 이질성이 포유류 배아 발달의 가소성을 보장하기 위해 필요하다고 생각한다.
키워드: embryogenesis, developmental plasticity, cell fate decision
분야: Cell_Biology, Developmental_Biology, Molecular_Biology
◈본문
1. 서론
초기 배아 발달은 일반적으로 진화적으로 보존된 과정으로써, 수정란은 여러 차례 세포 분열을 거치면서 여러 세포로 변한다. 분화된 계통이 나타나면서 각 세포군을 조성하는 세포들의 종류가 달라지기 시작한다. 이어서 계통간 상호 작용은 축 비대칭성을 확립하고 구획별 배아 구조를 지정하게 된다. 종간의 세부적인 차이는 있지만 배아 발생은 매우 자기 조직화된 과정으로써 외부 신호의 도움 없이도 이뤄질 수 있다. 이러한 자기 조직화된 특성을 설명하는 원리를 규명하는 것은 발달 생물학에서 중요한 목표가 되어왔다.
착상 전 초기 발달 단계에서 포유류 배아는 투명대(zona pellucida)라는 당단백질 층에 둘러 쌓이는데, 이 안에서 배아는 하나의 세포에서 수백 개의 세포로 이루어진 빈 구 형태인 배반포(blastocyst)로 발달한다. 배반포는 세 종류의 계통으로 나뉜다: 1) 영양 외배엽(trophectoderm(TE)): 태반의 전구체(progenitor); 2) 초기 내배엽(primitive endoderm(PE)): 난황 주머니(yolk sac)을 형성한다; 3) 배반엽 상층(epiblast(EPI)): 고유배(embryo proper)로 발달한다. TE 세포들은 배아 바깥쪽에서 단일 세포층을 형성하며, 포배강(blastocoel, 액체로 채워진 공간) 및 내세포 집단(inner cell mass(ICM), TE 구 한쪽에 모든 PE 및 EPI 세포들이 덩이를 형성하는 것)을 감싼다.
ICM이 쏠려 있는 쪽을 배아극(embryonic pole)이라 하며, 그 반대쪽에는 배아 반대극(ab-embryonic pole)이 있어서 배반포의 극성(polarity)을 보여준다. 배반포의 세 종류의 계통을 형성하는 것은 두 번의 세포 운명 결정을 통해 이뤄진다(그림 1). 이러한 과정은 외부 환경과는 독립적으로 내부 신호 전달 활성을 통해 이뤄지고 배반포의 자기 조직화 잠재력의 중요한 토대가 된다.
포유류 배아에서 세포 운명 결정에 대한 연구는 대부분 생쥐 배아를 이용하여 이뤄졌다. 생쥐 배아에서는 전체 형성능(totipotency)은 4세포기부터 서서히 사라지기 시작하는데, 이 시기에 세포마다 계통 전사 인자의 발현이 달라지게 된다. 첫 번째 세포 운명 결정을 통해 TE와 ICM 전구체가 분리되는데, 이러한 분리를 촉발할 때 필요한 것이 8세포기에 일어나는 세포 분극화(cell polarization)이다. 배아는 8세포기에서 압밀(compaction) 과정을 통해 느슨하게 붙어 있는 세포 모임에서 조직화된 형태로 바뀌게 된다.
압밀 과정과 더불어 각 세포들은 정점 영역(apical domain)을 형성하는데, 정점 영역은 TE와 ICM을 분리할 때 중요한 신호 조직자로 작용한다. 배아가 8세포기에서 16세포기로 가는 과정에서 정점 영역 구성 요소들은 모세포에서 딸세포로 전달되기도 하고 그렇지 않기도 한다. 정점 영역 구성 요소들을 전달받지 못한 딸세포들은 극성이 사라지며, 전달받은 딸세포들은 다시 정점 영역을 구성하여 극성을 띄게 된다.
극성이 사라진 세포에서는 Hippo 신호가 유지되어 하위 전사 인자인 Yap 및 Taz가 핵으로 이동하는 걸 막고, 다분화능(pluripotency) 전사 인자인 Nanog와 Sox2의 발현을 증가시켜 ICM로 발달한다. 반면 극성을 띄게 된 세포에서는 Hippo 신호가 억제되어 Yap과 Taz가 핵으로 이동하여 Cdx2와 Gata3의 발현이 유도되어 TE로 발달한다. TE가 지정되는 것은 32세포기에 종료되는데, 이때 배반포의 공동화(cavitation)가 시작된다.
첫 번째 세포 운명 결정이 종료되면 두 번째 세포 운명 결정이 시작된다. 두 번째 세포 운명 결정에서는 ICM 세포들에서는 Gata6의 발현이 다르게 나타난다. Gata6의 발현이 높은 세포에서는 Nanog의 발현이 줄고, FGF 수용체인 Fgfr1과 Fgfr2의 발현이 증가한다. Gata6의 발현이 적은 세포에서는 Nanog의 발현이 증가하고 FGF의 일종인 Fgf4의 발현이 증가한다.
두 종류의 세포 간의 FGF 신호 전달을 통해, Gata6가 많이 발현하는 세포는 PE로 발달하며, Nanog가 많이 발현하는 세포는 EPI로 발달하게 된다. 두 종류의 세포들은 처음에는 서로 섞여 있다가, PE 전구체들은 정점 극성 단백질을 발현하여 ICM 표면으로 이동하여 외피층을 형성한다. 착상하는 시점에서는 세 계통 모두 결정되어 배아가 투명대에서 벗어나 자궁에 착상할 수 있게 된다.
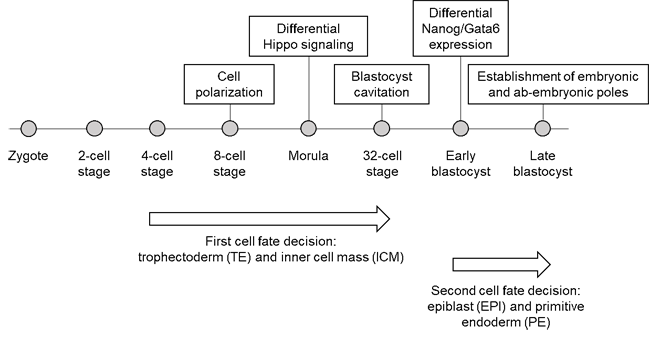
그림 1. 착상 전 초기 발달 단계와 세포 운명 결정. 착상 전 초기 발달 단계는 수정란(zygote)부터 시작하여 여러 번의 세포 분열 과정을 거치며 진행된다. 첫 번째 세포 운명 결정은 4세포기부터 시작하는데, 8세포기에 세포 분극화(cell polarization)이 일어나고, 상실배(morula, 16세포기와 32세포기 사이)일 때 Hippo 신호 전달이 세포마다 다르게 일어나며, 32세포기에 배반포 공동화(blastocyst cavitation)이 시작될 때 종료된다. 첫 번째 세포 운명 결정 결과 세포들이 세포들이 영양 외배엽(trophectoderm(TE))와 내세포집단(inner cell mass(ICM))으로 분화한다. 이어서 두 번째 세포 운명 결정 과정에서 초기 배반포의 내세포집단의 세포들에서 Nanog와 Gata6가 다르게 발현하여 배반엽 상층(epiblast(EPI))과 초기 내배엽(primitive endoderm(PE))으로 분화한다. 후기 배반포에서는 배아극(embryonic pole)과 배아 반대극(ab-embryonic pole)이 확립되어 배반포 전체가 극성을 띄게 된다.
포유류 배아 발달은 놀랍도록 자기 조직화가 잘 되어 있는데, 실험적 교란에도 불구하고 배반포는 바르게 발달할 수 있다. 배반포를 재구축하는 세포의 능력은 초기 배반포 단계에 이르기까지 오랜 기간 유지될 수 있다. 이 기간 동안 분화되는 계통들은 높은 세포 가소성을 가져서, 한 계통에서 세포가 소실되면 다른 계통에서 비대칭적 세포 분열이나 교차 분화(trans-differentiation)를 통해 보충한다.
이렇듯 조절되는 발달 과정을 가능하게 하는 기전은 오랜 기간 연구 대상이었고, 생화학적, 영상적, 수학적 모델링은 이러한 현상을 설명할 수 있게 하였다. 이 리뷰에서는 착상 전 발달 과정의 자기 조직화 특성을 설명하는 원리에 대해 논의할 것이다. 또한 착상 전 발달 과정의 가소성은 세 가지 인자를 수반하는 것이다: 1) 기하학적 제약; 2) 생물리학적 및 생화학적 인자간 피드백; 3) 세포의 이질성.
2. 기하학적 제약을 통한 계통 할당
착상 전의 배아는 전체적인 세포 이동을 유도하는 신호 전달 경로가 없기 때문에, 착상 전의 배아는 구형이고 세포 간 접합(cell adhesion)과 정점-기저 극성(apical-basal polarity)을 보임으로써 서로 붙어있다. 이러한 특성은 기하학적 인자가 세포 계통 할당(내부(ICM)와 외부(TE) 세포 숫자)을 조절하는 중요한 인자라는 주장을 뒷받침한다. 여기서는 기하학적 제약이 물리적 인자와 함께 ICM 및 TE 계통의 세포 수를 어떻게 조절하는지, 그리고 배아의 크기가 변함에 따라 어떻게 계통별 세포 수 비율이 자기 조절되는지에 대해 논의할 것이다.
상실배(morula) 단계에서 TE 전구체는 정점 영역이 있다는 점에서 ICM 전구체와 구분된다. 극성을 띄는 세포와 극성을 띄지 않는 세포는 16세포기와 32세포기에서 2번의 대칭적 및 비대칭적 세포 분열을 통해 처음 만들어진다. 하지만 극성을 띄지 않는 세포가 극성의 띄지 않기 위해서는 모든 세포막이 다른 세포로 둘러싸여야 하는데, 그러려면 극성의 띄지 않는 세포가 배아 안쪽에 존재해야 한다.
따라서 ICM 운명 결정을 위해서는 분열 패턴과 세포 위치 조건 모두가 충족되어야 한다. 액토마이오신 복합체(actomyosin complex)는 8세포기에 세포 피질(cellular cortex)을 둘러싸며 활성화되어 피질 장력(cortical tension)을 만들어낸다. 피질 장력은 극성을 띄지 않는 세포에서 높고, 극성을 띄는 세포에서는 낮은데, 정점 영역이 액토마이오신 복합체가 세포막에 자리 잡는 것을 억제하기 때문이다.
이러한 장력 차이로 인해 극성을 띄는 세포는 극성을 띄지 않는 세포와 접촉하면 평평해지고, 결과적으로 극성을 띄는 세포들이 극성을 띄지 않는 세포들을 감싸게 된다. 또한 16세포기 배아의 제한된 내부 공간이 배아 내부에 존재할 수 있는 극성을 띄지 않는 세포의 수를 제한하게 된다. 따라서 배아의 기하학적 특성이 극성을 띄는 세포와 극성을 띄지 않는 세포의 비율의 한계를 정하게 된다. 배아의 기하학적 특성이 TE와 ICM 계통 결정을 정하기 때문에 배아 크기에 따라 외부와 내부 세포 수가 조절된다.
공동화가 시작되면 빈 공간으로 인해 배아 크기가 커지며, 빈 공간의 크기가 물리적/생화학적 신호와의 피드백을 통해 계통 할당에 영향을 준다고 제안된 바 있다. TE 세포들이 성숙한 외피 조직을 형성하면, Na+/K+-ATPase가 TE 세포 간 접합(cell-cell junction) 사이의 세포 외 공간으로 액체를 내보내어 마이크로미터 크기의 공간을 여러 개 만든다.
두 개의 연결된 빈 공간이 크기가 다르면 압력 불균형으로 인해 액체가 작은 공간에서 큰 공간으로 이동하며, 궁극적으로 TE 구체의 내부에 하나의 큰 공간이 자리 잡게 된다. 빈 공간으로 액체가 계속 들어오면서 빈 공간이 팽창하는데, 그 결과 TE와 ICM 조직이 변형된다. TE 세포는 옆으로 뻗어서 물리적 압력을 형성하여, 밀착 접촉 단백질(tight junction protein)이 세포 간 접촉 부분에 모이도록 촉진한다.
또한 모여든 밀착 접촉 단백질은 액체를 펌핑하는 것을 촉진한다. 따라서 밀착 접촉 단백질이 모이는 것과 액체 펌핑 과정은 양성 피드백 고리(positive feedback loop)를 형성해 빈 공간이 팽창하도록 한다. 배반포의 최대 크기는 TE 층이 견딜 수 있는 최대 팽창 압력을 통해 결정된다.
전체적으로 착상 전 배아의 기하학적 특성은 여러 단계에서 계통 분배와 관련되어 있다. 이는 어떤 계통에서 세포가 소실되어도 TE 및 ICM 계통의 세포 수 비율의 균형을 맞출 수 있도록 하기도 한다.
3. 조절 피드백을 통한 계통 정체성 자기 강화
기하학적 제한이 배아 크기에 따라 배아 내부 및 외부의 세포 비율을 조절할 수 있게 하는 가운데, 세포 운명 결정의 유연성은 전사적 수준(transcriptional level)에서의 가소성을 필요로 한다. 첫 번째 및 두 번째 세포 운명 결정에서 계통 지정은 하루 정도가 걸린다. 이 시간 동안 분화하는 계통은 외부 환경 변화에 따라 미리 결정된 운명을 바꿀 수 있다.
첫 번째 및 두 번째 세포 운명 결정에서 공유하는 특성이 있다는 것은 두 결정 과정이 공유하는 보존된 조절 원리가 있다는 것을 시사하며, 세포 가소성이 있는 가운데 확고한 세포 운명 분기를 가능하게 한다.
4. 자가 조절 회로와 상호 억제
첫 번째와 두 번째 세포 운명 결정에는 계통 특이적인 전사 인자들을 통해 각각 두 종류의 결과가 나타난다. 세포 운명 결정이 시작되면 세포들은 계통 전사 인자들을 다양하게 발현하는데, 많은 계통 전사 인자들(Cdx2, Nanog, Oct4, Sox2 등)은 이들 자신의 프로모터(promoter)에 붙어 스스로의 발현을 촉진하여 자가 조절 회로를 형성하고, 결과적으로 이들 자신의 발현을 빠르게 촉진할 수 있다.
또한 계통 전사 인자들은 복잡한 유전자 조절 네트워크를 형성하는데, 같은 계통을 결정하는 인자끼리 서로 촉진하고, 다른 계통을 결정하는 인자끼리는 상호 억제한다. 예를 들어 첫 번째 세포 운명 결정 때 TE 전사 인자들(Cdx2, Gata3)과 ICM 전사 인자들(Nanog, Oct4, Sox2)은 상호 억제하며, 두 번째 세포 운명 결정 때 EPI 전사 인자들(Nanog, Oct3/4, Sox2)과 PE 전사 인자들(Gata4, Gata6)은 상호 억제한다(그림 2).
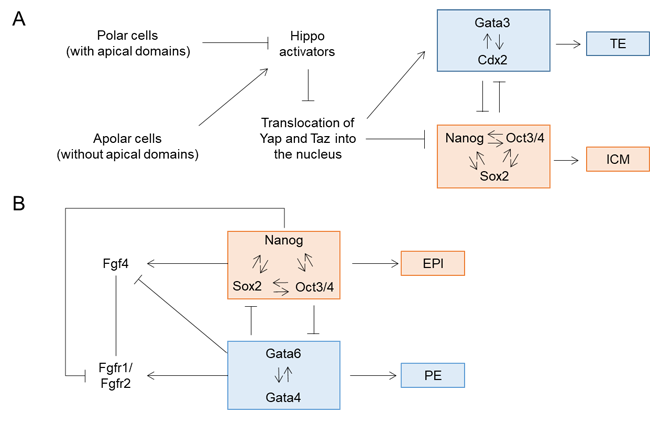
그림 2. 세포 운명 결정 때 나타나는 유전자 조절 네트워크. (A) 첫 번째 세포 운명 결정에서 정점 영역(apical domain)을 가지는 세포와 가지지 않는 세포가 생기는데, 정점 영역이 있으면(극성을 띄는 세포) Hippo activator 활성이 억제되며 정점 영역이 없으면(극성을 띄지 않는 세포) Hippo activator 활성이 유지된다. 극성을 띄는 세포에서는 하위 전사 인자인 Yap과 Taz가 핵으로 이동하여 Gata3와 Cdx2의 발현이 유도되어 영양 외배엽(trophectoderm(TE)으로 분화한다. 극성을 띄지 않는 세포에서는 하위 전사 인자인 Yap과 Taz가 핵으로 이동하지 못해 Nanog, Sox2, Oct3/4의 발현이 유도되어 내세포집단(inner cell mass(ICM))으로 분화한다. (B) 두 번째 세포 운명 결정에서 ICM을 구성하는 세포들에서 Gata6의 발현이 달라진다. Gata6의 발현이 높은 세포에서는 Gata4의 발현도 증가하며, Fgfr1 및 Fgfr2의 발현이 증가하며, Gata6의 발현이 낮은 세포에서는 Nanog, Sox2, Oct3/4의 발현이 증가하며 Fgf4의 발현이 증가한다. 두 종류의 세포들은 Fgfr1/Fgfr2-Fgf4 결합을 통한 신호 전달을 통해 Gata6의 발현이 높은 세포는 배반엽 상층(epiblast(EPI))으로, Gata6의 발현이 낮고 Nanog의 발현이 높은 세포는 초기 내배엽(primitive endoderm(PE))으로 분화한다.
5. 생화학적 신호 모듈간 피드백
유전자 수준에서 작동하는 조절 네트워크 외에도 전사 및 형태 발생적 과정의 피드백 그리고 세포 운명 결정 관련 생화학적 신호 전달의 다양한 과정 간의 피드백이 존재한다. 이들 피드백들은 세포 운명 결정에서 추가적인 신호를 제공한다.
착상 전 단계에서 많은 중요한 발달 과정은 배아의 크기와 관계없이 수정 후 특정 시간에 나타나도록 내재화되어 있다. 이러한 시간적 특성은 세포 극성화에서 가장 두드러지게 나타난다. 고유의 발달 시간 설정기는 전사 및 세포 자율 정점 단백질 역학 사이의 연결을 구성한다. 정점 영역 형성은 두 가지 중요한 요건을 필요로 하는데, 하나는 2세포기에 나타나는 접합 유전체 활성화(zygotic genome activation, ZGA)이고 다른 하나는 액토마이오신 복합체가 세포 피질에 자리 잡는 것이다.
접합 유전체 활성화를 통해 Tfap2c와 Tead4라는 전사 인자의 발현이 활성화되며, 8세포기에 충분히 발현이 높아져 하위 표적의 발현을 유도하고, 세포 골격(cytoskeleton)을 재조직하며, 정점 단백 질이 세포 간 접촉이 없는 면으로 모이게 된다. 정점 단백질이 모이는 속도는 정점 단백질의 국소 농도와 상관관계가 있는데, 정점 단백질의 국소 농도가 낮은 부분에서는 정점 단백질이 분산되고, 국소 농도가 문턱 농도보다 높은 곳에서는 정점 단백질이 축적되어 정점 영역을 형성한다.
이러한 현상을 협동 모집(cooperative recruitment)이라고 한다. 협동 모집이 정점 단백질을 극성화할 수 있지만 끝부분 모양 형성을 위해서는 정점 단백질의 측면 퍼짐(lateral spreading)이 필요하다. 분자적 수준에서 정점 단백질의 측면 퍼짐은 protein kinase C, Rho GTPase, 액토마이오신 신호 축이 조절한다.
전사 및 형태 발생적 과정의 피드백 외에도 생화학적 신호 전달 모듈 간의 피드백도 세포 운명 결정에서 중요하다. 첫 번째 세포 운명 결정에서 세포 극성과 위치가 Hippo 활성을 조절하여 세포 운명 결정 관련 전사 인자의 발현을 정하며, Hippo 활성도 세포 극성과 위치를 조절한다. 세포 극성은 외부 세포에서 Lats kinase 활성을 억제하고, Lats kinase의 낮은 활성은 세포의 극성을 유지하는 데 도움을 준다.
이러한 방법으로 Hippo 경로는 세포 위치와 양방향으로 상호 작용하여 상실배 단계에서 세포 운명을 조절한다. 상실배 단계에서 Tead4-Yap 복합체는 세포 극성 확립뿐만 아니라 ICM 전사 인자 Sox2가 성급하게 발현하는 것을 억제한다. 따라서 세포 극성, Hippo 신호, 세포 위치는 시공간적으로 모두 서로 피드백하면서 확고하게 세포 운명을 결정한다. 또한 세포 운명 결정 인자들의 발현은 세포 극성과의 직접적인 피드백을 형성한다.
FGF-MAPK 신호 전달 경로는 PE 및 EPI 계통을 결정하는데 중요하다. FGF(Fgf4)의 발현은 Nanog가 촉진하며 Gata6가 억제하며, FGF 수용체(Fgfr1과 Fgfr2)는 Gata6가 유도하지만 Nanog는 그렇지 않다.
이러한 방법으로 계통 전사 인자 발현 정도는 각 세포에서 FGF와 수용체의 발현 비율과 관련 있다. FGF 수용체의 발현 정도는 세포 내 MAPK 신호 전달과, 이어지는 Gata6 발현을 통한 양성 피드백 형성과 관련 있다. 종합적으로 볼 때 다양한 피드백 경로가 배아 패턴화 과정을 가능하게 하며, 동시에 패턴화가 배아 크기 변화에 적응하여 발달 과정을 조절할 수 있도록 한다.
6. 세포 자살 매개 세포 제거를 통한 정확한 패턴화
첫 번째와 두 번째 세포 운명 결정 과정에서 나타나는 세포 계통들은 공간적으로 분리된다. 하지만 때때로 일부 세포들이 잘못된 위치에 자리 잡기도 하는데, 첫 번째 세포 운명 결정보다 두 번째 세포 운명 결정에서 좀 더 높은 빈도로 나타난다. 두 경우 모두 EPI 세포가 있을 곳에 잘못 자리 잡은 세포들은 후기 배반포 단계에서 세포 자살(apoptosis)을 통해 제거된다. 세포 전사 인자의 발현과 세포 위치 사이의 불일치성이 어떻게 세포 자살을 유도하는지는 명확하지 않다.
세포 계통들이 특정 세포 표면 단백질에 의해 결정되고, 세포 표면 단백질 간의 동종 상호 작용(homophilic interaction)이 세포 생존에 중요할 수도 있고, 세포막에 있는 정점 극성 복합체가 TE 및 PE 세포의 생존에 필수적일 수도 있다. 종합적으로 세포 자살 매개 교정 기작을 통해 EPI의 동질성이 유지되고, 배반포 세포 계통들이 정확하게 패턴화될 수 있다. 한편 염색체에 문제가 있는 세포들도 세포 자살을 통해 제거되는데, 이들을 올바른 계통 표지자를 띄는 경우가 많기 때문에 계통 표지자 이외의 기작을 통해 제거될 가능성이 크다. 전체적으로 자기 교정 기작은 정상적인 발달 과정을 가능하게 한다.
7. 세포의 이질성을 통한 계통 패턴화
포유류 배아 발달은 가장 초기의 발달 단계부터 세포의 이질성이 수반된다. 세포 운명 결정 조절자인 Nanog, Cdx2, Gata6 등의 발현 패턴은 세포 운명 결정 과정의 시작부터 상당한 수준으로 이질성을 보인다. 이들 조절자의 이질적인 발현의 원인은 완전히 규명되지 않았지만, 상위 조절자의 이질적인 활성에 의한 것으로 볼 수 있다.
실제로 2세포기 또는 4세포기에 이질적으로 발현하거나 활성 있는 분자들이 있으며, 이들 중 일부는 8세포기에서 Cdx2나 Nanog에 영향을 준다고 밝혀졌다. 이러한 분자들 중 하나가 히스톤 아르기닌 메틸전달효소(histone arginine methyltransferase)인 Carm1이다. Carm1은 히스톤 H3의 26번 아르기닌의 메틸화(H3R26me)에 관여하는데 핵체(nuclear body)의 일종인 paraspeckle에 존재한다.
Carm1 발현 정도는 4세포기의 세포들에서 다르게 나타나며, TE-ICM 운명 결정에 관여하는데, Carm1 발현이 높으면 ICM으로, 낮으면 TE가 된다. Carm1은 Sox2나 Nanog의 발현을 촉진하여 세포 운명 결정에 기여한다. 또한 Carm1은 비정형적인 protein kinase C의 우성 음성형(dominant-negative form)의 발현을 활성화하여 세포 극성에 영향을 주고, TE로의 분화를 억제한다. 한편 Carm1은 BAF155를 메틸화하는 방법으로 케라틴 필라멘트(keratin filament) 조직화도 조절하는데, 케라틴 필라멘트는 극성을 띄는 세포에서 피질 장력에 관여하고 Yap 전사 인자가 핵 내부에 자리 잡아 TE로 분화하는 것에 관여한다.
Carm1 발현이 높으면 BAF155가 메틸화되어 케라틴 발현을 활성화할 수 없게 되어 TE로의 분화가 억제되며, 낮으면 BAF155가 케라틴 발현이 증가하여 TE로의 분화가 촉진된다.
배아의 4세포기에서 Carm1 발현의 차이를 결정하는 것은 non-coding RNA LincGET이다. LincGET 발현은 2세포기에 시작하는데, 두 세포 사이에서 다르게 발현한다. LincGET은 Carm1과 상호 작용하여 Carm1이 핵 내부에 위치하는 것을 돕는다. LIncGET 발현의 차이를 야기하는 인자는 알려져 있지 않지만 두 세포 간의 유전체 활성화 시점 차이로 인한 것일 수 있다.
특정 세포 운명 결정 인자가 세포 운명 결정 과정 전에 이질적으로 발현하는 것은 명확하지만, 세포의 이질성이 어떻게 배아 발달에 도움이 되는지는 밝혀지지 않았다. 세포의 계통을 유지하기 위해서는 해당 계통 조절자의 발현이 반대 계통 조절자의 발현보다 우월해야 하기 때문에, 상호 억제와 양성 피드백 고리는 한 계통 조절자의 발현을 안정화하는 데 필요하다.
이런 점에서 초기의 이질적인 조건이 발달 과정의 제한된 시간 동안 세포 계통 지정을 확고하게 하기 위한 대칭 파괴 과정(symmetry breaking process)을 신속하게 할 수 있다. 또한 이질적인 발현은 세포들이 손상 조건에 빠르게 대응하게 해줄 가능성도 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0003875.pdf
pdf_0003875.pdf