기술동향
숙주-미생물 상호작용
- 등록일2021-10-01
- 조회수5019
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2021-09-28
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#숙주-미생물 #상호작용
- 첨부파일
숙주-미생물 상호작용
◈목차
1. 서론
2. 본론
2.1. 장(intestine) 항상성 유지에서 미생물과 숙주의 선천적 면역 시스템의 상호작용
2.2. 장(intestine) 항상성 유지에서 미생물과 숙주의 후천적 면역 시스템의 상호작용
2.3. 염증성 장 질환(IBD)에서 미생물과 숙주의 상호작용
2.4. 피부(skin) 항상성 유지에서 미생물과 숙주의 상호 작용
2.5. 피부(skin) 질환에서 미생물과 숙주의 상호작용
2.6. 폐(lung)에서 미생물과 숙주의 상호 작용
2.7. 간(liver)에서 미생물과 숙주의 상호 작용
2.8. 류마티스 질환(rheumatoid arthritis)에서 미생물과 숙주의 상호 작용
2.9. 심근 대사 질환(cardiometabolic diseases)에서 미생물과 숙주의 상호 작용
2.10. 암(cancer)에서 미생물과 숙주의 상호 작용
3. 결론
4. 참고 문헌
◈요약문
숙주와 미생물(바이러스, 박테리아, 곰팡이, 기생충)의 상호작용에 대한 이해로 거의 한 세기가 넘는 동안 미생물이 감염되었을 때 질병을 유발하는 요인으로 작용한다는 것에 초점을 둔 연구들이 대부분이었다. 하지만, 최근 10여 년 동안에는 다양한 연구 기법들로 미생물과 숙주의 상호작용이 항상 질병을 초래하는 것이 아니라 건강에 유익한 방향으로 작용할 수도 있다는 것이 밝혀지면서 숙주와 미생물의 관계의 폭이 기존의 생각보다 매우 다양하고 복잡한 시스템인 것으로 확인되었다.
미생물이 숙주 세포 및 조직과 어떻게 상호작용하는지에 대한 깊은 통찰과 특히 병원체가 감염된 후 질병을 일으키는 메커니즘에 대한 이해는 미생물이 야기하는 질병을 예방하고 치료법을 개발하는 데 필수적이다. 따라서, 본문에서는 숙주와 미생물 간의 현재까지 알려져 있는 다중적인 상호작용에 대해 자세히 서술하고 또 향후 필요한 연구들은 무엇인지에 대해 서술하고자 한다.
키워드: 마이크로바이옴(microbiome), 장(intestine), 피부(skin), 항상성(homeostasis), 질환(diseases)
분야: Microbiology, Immunology
◈본문
1. 서론
미생물(microbes)은 우리 환경 어디에나 존재하며, 숙주(host)의 세포 수보다 미생물의 수가 훨씬 우세하다. 우리는 매일 수천 개의 유기체들을 섭취 및 흡입하지만 대부분의 경우 숙주 세포의 보호 메커니즘으로 인해 이들에 대한 부작용이 일어나지 않는다. 미생물과 숙주의 공통적인 목표는 생존이므로 숙주와 미생물의 상호작용이 양쪽 모두에게 이로운 방향으로 작용하여 항상성 확립과 유지에 필수적인 것으로 밝혀지고 있다.
이렇게 미생물이 숙주와의 상호작용을 통해 서로 유익한 관계를 유지하지만, 숙주의 유전적 돌연변이, 건강 상태, 나이, 스트레스 등의 요인들에 따라 미생물은 국소적으로나 전신적으로 감염병을 유발하는 요인이 될 수 있다.
숙주와 미생물 간의 항상성 유지 또는 질병의 유발에 대한 다중적인 상호작용이 가장 활발하게 연구되고 있는 인터페이스(interface)는 장 점막(intestine)과 피부(skin)이다. 장 점막과 피부 그 외 기타 점막 환경을 포함하여 인체에는 엄청난 숫자 및 양의 미생물들이 식민지화(colonization)하여 집단적으로 서식하고 있는데 이들을 마이크로바이옴(microbiome)이라 명명한다.
이들 마이크로바이옴은 숙주의 선천적(innate), 후천적(adaptive) 면역 시스템(immune system)의 구성요소들을 훈련 시키고 성숙(maturation)할 수 있도록 하는 데 결정적인 역할을 하는 것으로 알려져 있다. 사람의 경우 생후 일 년 동안 이들 마이크로바이옴에 의한 면역 시스템의 발달이 거의 결정되며, 성인기의 마이크로바이옴의 구성은 생후 3세 이전에 거의 완성되는 것으로 알려져 있다. 영아기 때 형성되어지는 마이크로바이옴의 조성은 주로 산모의 자궁 환경 및 모유를 통해서 결정되는 것으로 알려져 있다.
그리고 숙주의 면역 시스템(immune system)은 마이크로바이옴(microbiome)과의 공생관계(symbiosis)를 잘 유지하도록 훈련되어있는데, 무해한(harmless) 미생물에 대해서는 면역 관용(immune tolerance) 등을 통해 공생관계가 정밀하게 조절되고 있지만, 이러한 면역 시스템의 유전적 결함은 때론 질병의 요인으로 작용할 수도 있다 (그림 1).
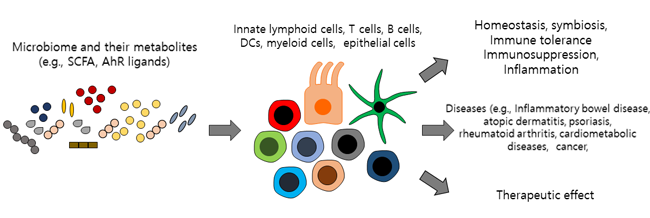
그림 1. 마이크로바이옴-숙주의 상호작용(microbiome-host interaction)
본론에서는 인간의 장 점막(intestine)과 피부(skin) 조직 등에서 숙주와 미생물 간의 상호작용이 서로에게 미치는 영향, 그 각각의 특징 및 기능을 알아보고자 한다. 그리고 이러한 상호작용을 조절하는 분자 메커니즘(mechanisms)에 대한 이해와 건강을 위한 미생물 표적 치료법 등에 관해 현재까지 알려져 있는 지식과 또한 앞으로 해결해야 할 과제가 무엇인지에 관해 서술하고자 한다.
2. 본론
2.1. 장(intestine) 항상성 유지에서 미생물과 숙주의 선천적 면역 시스템의 상호작용
장내 미생물은 단일 층의 상피 세포(epithelial cells)와 점액층(mucus layer)에 의해 장 내부와 엄격하게 분리된다. 장 내부의 B 세포(B cells)에서 합성된 후 밖으로 분비되는 IgA 항체 및 상피 세포 층에서 합성된 후 밖으로 분비되는 항균 펩타이드(antimicrobial peptides, AMPs)는 미생물과 숙주의 항상성 유지에 중요한 역할을 하는 것으로 알려져 있다. 또한 선천적 면역 반응(innate immune responses)에 관여하는 것으로 잘 알려져 있는 선천적 면역 세포(innate lymphoid cells, ILCs), 수지상 세포(dendritic cells, DCs)가 미생물의 특정 성분들을 직접적으로 인지함으로써 항상성 유지에 기여할 수 있다 (그림 2) [1].
그리고 장내 미생물군의 조성 및 성분들은 선천적 면역 세포(Innate lymphoid cells, ILCs)의 기능 및 다양성을 결정지을 수 있는 것으로도 알려져 있다. 예를 들면 장내 미생물의 특정 대사 산물은 ILC3 세포에 발현하고 있는 Ffar2 (Free Fatty Acid Receptor 2)를 통해서 ILC3 세포 증식 및 기능을 조절할 수 있고, 흔한 장내 미생물 중의 하나인 절편섬유상세균(segmented filamentous bacteria, SFB)은 ILC3를 활성화시켜서 Th17-T 세포로부터 IL-17A 생성을 촉진시킬 수 있다 (그림 2) [2, 3].
그리고 ILC3 세포는 마우스 실험에서 시트로박터 로덴티움(Citrobacter rodentium) 감염 동안 맹장(caecum)의 항상성 유지에 중요한 역할을 한다는 것이 확인되었다 [4]. 루미노코커스 그나부스(Ruminococcus gnavus)는 ILC2의 활성화를 통해 대장(colon)으로 호염구(eosinophils), 비만 세포(mast cells)를 불러 모으는 데 중요한 역할을 한다 [5].
수지상 세포(DCs)는 상피 층(epithelial layer) 바깥으로 돌기(dendrite)를 뻗어 장내 미생물의 특정 성분들을 직접적으로 인지하고, 항원(antigen)을 CD4+ T 세포 (CD4+ T cells)에 제시(presentation)함으로써 후천적(adaptive) 면역 시스템의 구성 요소들을 교육 시키고, 발달에 기여할 수 있다. 상피 세포(epithelial cells), 수지상 세포(DCs) 등에 발현하고 있는 패턴인식 수용체 (Pat-tern recognition receptors, PRRs)인, 톨라이크 수용체(Toll-like receptors, TLRs), 노드라이크 수용체(Nod-like receptor, NOD)는 미생물들의 특정 성분들을 감지하는 데 중요한 역할을 한다 (그림 2) [1].
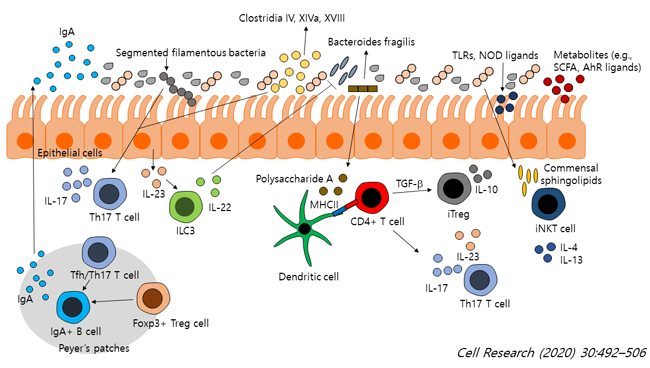
그림 2. 장 점막과 미생물의 항상성에서의 상호작용
(Intestinal microbiota-immunity interplay in homeostasis)
예를 들면, 톨라이크 수용체2/1 (TLR2/1) 및 덱틴-1 (dectin-1)은 장내 미생물 중의 하나인 박테로이데스 프라질리스(Bacteroides fragilis)의 다당류 성분인 폴리사카라이드 A (Polysaccharide A, PSA)를 인지하여 항상성 유지 및 면역 시스템 구성 요소들을 교육시키는데 관여한다 [6-8].
톨라이크 수용체(TLRs)의 하위 시그널에 중요한 분자인 MyD88이 결핍된 마우스에서 마이크로바이옴의 조성이 변형되고, 항균 펩타이드(AMPs)의 발현이 감소하는 결과를 볼 때, 톨라이크 수용체(TLRs)가 항상성 유지에 중요한 역할을 한다는 것을 알 수 있다 [9]. 또한 MyD88은 Th17 세포의 분화 및 IgA 생성에 있어서도 중요한 역할을 한다 (그림 2) [10].
노드라이크 수용체(NOD-like receptors, NLRs)인 nucleotide-binding oligomerization domain-containing protein 1 (NOD1)은 장내 미생물의 펩티도글리칸(peptidoglycan)을 인지하여 면역 반응을 유발할 수 있고, 림프 조직(adaptive lymphoid tissues)의 생성을 도와 항상성 유지에도 기여할 수 있다 [11].
노드라이크 수용체 NOD2는 장내 미생물 중의 하나인 박테로이데스 불가투스(Bacteroides vulgatus)의 성장을 억제함으로써 장 염증 반응을 억제하고, 장 상피 층(epithelial layer)에 존재하는 줄기 세포(stem cell)의 성장을 촉진하여 상피 층(epithelial layer)의 재생을 조절할 수 있다 [12, 13].
그 외 여러 가지 세포들에서도 노드라이크 수용체 NLRs의 발현이 확인되고 있는데, 다단백 복합체로 조립되는 인플라마솜(inflammasomes)은 사이토카인(cytokines) 인터루킨-1β (IL-1β), 인터루킨-18 (IL-18)을 활성화 상태로 전환시키는 데 관여하는 효소인 케스페이즈-1 (caspases-1)의 활성화를 촉진하고, 파이롭토시스(pyroptosis)라는 세포 사멸을 촉진하는 것으로 알려져 있다 [14, 15].
인플라마솜(inflammasomes) 중 하나인 NLRP6는 장내 미생물의 대사체(metabolites)를 인지하여 상피 세포(epithelial cells)로부터 인터루킨-18 (IL-18)과 항균 펩타이드(AMPs)의 분비를 촉진시켜서 장내 미생물의 조성을 제어하고 항상성 유지에 기여할 수 있다 [15].
또 NLRP6는 상피 층(epithelial layer)에 존재하는 고블릿 세포(goblet cells)가 점액(mucus)을 분비하는 것을 촉진하게 하여 병원성 미생물의 감염을 억제하는 데 기여할 수 있다 [16, 17]. 마우스의 장내 미생물인 트리코모나스(Trichomonas musculis)는 상피 세포(epithelial cells)의 인플라마솜(inflammasomes)을 활성화시켜서 T 세포(Th1/Th17)의 활성화를 촉진하고 병원성 균의 감염에 있어서 숙주를 보호하는 역할을 한다 [18].
장내 미생물의 성분을 인지하여 인플라마솜(inflammasomes)을 활성화시킬 수 있는 또 다른 분자인 absent in melanoma 2 (AIM2)는 인터루킨-18/인터루킨-22 (IL-18/IL-22)의 발현을 유도함으로써 장의 항상성을 조절할 수 있다 [19]. 인플라마솜 NLRP3는 장의 염증 반응에서 중요한 역할을 하는데, 궤양성(ulcerative colitis) 환자에서 NLRP3 활성화는 인터루킨-1β (IL-1β)의 활성을 촉진할 수 있다 [20].
프로테우스 미라빌리스(Proteus mirabilis)는 장의 선천성 면역 세포에 발현하는 NLRP3를 활성화시켜서 인터루킨-1β (IL-1β)의 생성을 촉진하여 장의 염증 반응을 더욱 유도할 수 있다 [20].
선천적 면역 세포(innate lymphoid cells, ILCs), 수지상 세포(dendritic cells, DCs) 외에도 장내 미생물 유래의 다당류(polysaccharide)가 장내 대식세포(macrophages)를 활성화시켜서 항염증 유전자의 발현을 증가시킬 수 있고, 장내 세균 유래의 짧은 사슬 지방산인 부티레이트(short chain fatty acid butyrate)는 장내 단세포(monocytes)를 대식세포(macrophages)로의 분화를 유도하여 항염증 반응을 더욱 촉진시킬 수 있는 것으로 알려져 있다 [21, 22].
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 pdf_0003885.pdf
pdf_0003885.pdf