기술동향
한국의 노화연구 - 세포 노화의 분자메카니즘
- 등록일1999-05-13
- 조회수18007
- 분류기술동향
출처: biozine
세포 노화의 분자메카니즘
?신득용 ??/ ??생명공학연구소 단백질기능??R.U. ??선임연구원
약 ??30 ??년전 ??Hayflick??과 ??Moorhead??는 ??in vitro ??세포 배양계에서 정상 ??fibroblast??의 성장이 항상 일정한 회수 의 세포분열 후에 정지한다는 연구결과를 보고하였다??. ??그후 이러한 세포의 유한 증식능은 다른 종류의 세 포 배양계에서도 계속 보고되었다??. ??세포는 증식할 수 있는 제한된 능력을 가지고 있다??. ??세포는 정해진 회수 의 세포분열 후 노화??(senescence)??라고 불리우는 비가역적인 증식 정지기 ??(irreversible growth arrest ??혹 은 ??terminally non-dividing state)??에 들어간다??. ??
이러한 세포의 노화는 결국 생명체의 노화 진행에 영향을 미친다??. ??세포의 노화는 세포사멸 ??(apoptosis, ??혹은 ??programmed cell death)??과는 다르다??. ??노화세포는 장기간 동안 죽지 않고 살아 있으며 세포의 노화가 진행되면서 세포주기의 시간이 길어지는데??, ??이는 ??G1??기가 길어지기 때문이며 완전히 노화한 세포는 ??G1??기에서 정지한다??. G1??기에서 정지한 노화세포는 증식 정지기??(Go??기??)??의 세포와 는 달리 ??growth factor ??등으로 증식을 자극해도 세포주기를 시작하지 않는다??. ??
세포융합을 이용한 세포학적 실험 결과 노화세포는 세포증식을 억제하는 증식억제 인자를 적극적으로 발현하고 있다??. 1993??년 노화세포 가 발현하는 증식 억제인자의 하나가 발표되었다??. ??이 인자는 세포주기 ??G1 cyclin-cdk complex (cyclin D/E- cdk2/4)??와 결합하여 불활성화하는 단백질로서 이를 발견한 학자들에 의해서 ??p21, WAF-1, CIP ??등으로 명명되 었다??. ??따라서 세포의 노화는 세포주기 조절기능과 밀접한 관련이 있을 것이다??. ??
또한 암 발생 메카니즘과도 관련이 있다??.
1. ??세포노화의 유전적 프로그램??: ??노화유전자의 존재 세포 노화 프로그램으로부터 벗어난 암세포를 정상 세포와 융합시켜서 만든 ??hybrid ??세포는 정상세포와 같 이 수차례 세포분열 후 노화가 일어난다 ??(??그림 ??1). ??이것은 세포노화가 우성 형질 ??(dominant phenotype)??이라 는 것을 시사한다??. ??즉 암세포의 불멸화는 세포 노화에 관여하는 유전자의 ??recessive mutation??의 결과인 것 이다??. ??
만약 다수의 유전자가 세포노화의 유도에 관여한다면??, ??불멸화 세포??(??혹은 암세포??)??간의 ??fusion??에 의한 ??hybrid??세포에서 세포노화 혹은 불멸화가 관찰될 것이다??. hybrid ??세포가 노화를 일으킨다면 그 모세포 ??(??불멸 화 세포??)??는 서로 다른 유전자 결손을 가지고 있을 것이다??. ??그러나 만약 ??hybrid??세포가 여전히 노화를 일으키 지 않으면 두종류의 모세포는 동일한 유전자의 변이를 가진다고 추정할 수 있다??. ??즉 동일한 상보 그룹 ??(complementation group)??임을 알 수 있다??. ??이러한 유전학적인 해석이 약 ??40??종류의 불멸화 세포간에서 이루 어졌고 그 결과 최소한 ??4??종류의 ??complementation group??의 유전자가 노화를 조절하고 있음을 알게 되었다??. Microcell-mediated chromosome transfer??기법의 발전에 의하여 하나의 정상 염색체를 불멸화된 세포에 도입 하고 세포증식의 변화를 관찰할 수 있게 되었다??. ??불멸화된 세포에 ??1, 4, 6, 7, 11, 18??번 및 ??X ??염색체를 도 입하면 세포의 노화가 유도되는 것이 관찰되었다??. 1??번 염색체는 ??group C, 4??번 염색체는 ??group B, 7??번 염색 체는 ??group D??에 속하는 불멸화세포의 노화를 유도한다??. ??그러나 ??6, 11, 18 ??및 ??X ??염색체는 하나의 ??complementation group??으로 분류되지 않은 불멸화세포의 노화를 유도한다??. ??그러므로 ??4 ??종류 이상의 ??complementation group??이 존재할 것으로 추정된다??. ?
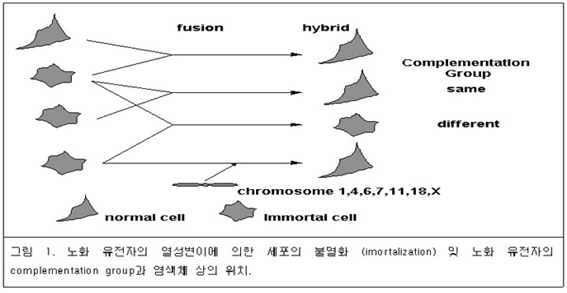
? ??2. ??수명 유전자 ??(longevity-associated gene)??의 존재와 기능 사람을 비롯한 동물의 수명은 어떻게 결정되는 것일까??? ??
과연 분자생물학 연구는 사람의 수명을 늘릴 수 있 는 혹은 노화를 지연시킬 수 있는 방법을 찾아낼수 있을까??? ??이에 대한 부분적인 대답을 최근의 ??Science (275, 980-983, 1997)??에 실린 ??Hekimi??박사 연구팀의 논문에서 찾을 수 있다??. ??동물의 수명 혹은 노화의 속도를 결정하는 인자에 대하여 두가지의 가설이 서로 대립하기도 하고 상호보완 되기도 하면서 발전해 왔다??. ??
첫번째의 가설은 대사의 속도가 수명을 결정할 것이라는 생각이다??. ??각 동물은 일정한 대사능력을 가지고 있고 대사속도가 빠를수록 노화가 빨리 일어나며 수명도 짧아진다는 것이다??. ??두 번째 가설은 수명은 유전학적으로 결정이 된다는 것이다??. ??이러한 관점에서 본다면 노화 혹은 수명을 측정하 는 시계는 각 동물에게 각기 다른 속도로 맞추어진 유전적 프로그램일 것이다.?
Hekimi ??박사 연구팀이 발표한 ??caenorhabditis legans??의 ??clk1 ??유전자 클로닝 및 구조분석 결과는 전술의 두 가지 가설 모두를 동시에 지지하고 있다??. mutant clk1 ??유전자를 가지고 있는 연충은 ??wild type clk1 ??유전자 를 가지는 연충에 비하여 약 ??50% ??정도 수명이 길다??. mutant clk1??을 가지는 연충은 발생초기의 ??cell cycle ??과 ??embryonic development??의 속도가 늦고??, ??성체가 되어서도 ??swimming, pumping, defecation ??등의 리듬 행동 에 장애를 나타낸다??. clk1 ??변이의 효과는 ??maternal effect??를 보여주는데 이는 ??clk1 ??유전자가 ??egg ??혹은 발 생 초기에 작용하는 것을 시사해 준다??. clk1 mutant ??연충이 세포의 성장 및 발생 속도가 느린 것은 ??clk1 mutation??이 세포의 대사능력에 변화를 유발하기 때문일 것으로 추측해 왔다??. clk1 ??유전자의 클로닝 및 염기배열의 분석은 유전자의 기능에 관한 추측을 가능하게 한다??. clk1 ??유전자는 효모 ??rat??의 ??CAT5 ??유전자와 상동성이 있다??. rat??으로부터 클로닝한 ??CAT5 ??유전자와 마찬가지로 ??clk1 ??유전자 가 효모의 ??cat5 mutation??을 ??complementaion??하는 것은 이들 유전자가 구조와 기능이 잘 보존되어 있음을 시 사해 준다??. ??
효모의 ??CAT5 gene??은 ??glycerol, ethanol ??등의 비발효성 ??carbon sources??의 대사에 필요한 유전자 의 전사조절에 관여한다고 알려져 있다??. cat5 ??변이주는 ??glycerol ??혹은 ??ethanol ??등의 배지에서 증식할 수 없 으며 ??gluconeogenesis, respiration, glyoxylate cycle ??등에 필요한 ??enzyme??의 발현이 일어나지 않는다??. ??효 모 ??CAT5 ??유전자의 구체적인 조절기작은 아직 불분명하지만 세포의 다양한 ??metabolism pathway??의 ??co- regulation mechanism??에 관여할 것으로 추측된다??. ??연충의 ??clk1 mutation??도 서로 다른 ??metabolic pathway??에 관여하는 것으로 미루어 볼때 효모의 ??CAT5??와 같이 ??metabolic coordination??을 위한 조절기작에 관여할 것이다??. clk1 ??유전자가 효모의 ??metabolic regulator??와 구조 및 기능에 있어서 유사하다는 발견은 ??clk1 mutation??에 의하여 대사속도가 ??slow down??되고 노화의 속도가 지연 됨으로써 ??mutant ??연충의 수명이 연장된다고 추측할 수 있다??. ??
앞으로 연충과 효모에 있어서 이들 유전자의 기능이 밝혀지면 대사속도의 조절 및 대사의 ??by- product ??생성이 어떻게 노화의 속도와 수명기간을 조절하는 지 알 수 있을 것이다??. Superoxide dismutase ??유전자를 발현하는 ??transgenic fly??가 수명이 연장된다는 사실이 최근 알려져 있는데??, ??이 사실은 대사의 부 산물 ??(toxic by-product)??에 의해서 세포내 ??damage??가 축적됨으로써 노화가 촉진되고 수명이 짧아지는 것을 시사한다??. ??
그러나 대사 속도 및 세포내 ??damage??의 축적이 노화의 전 과정을 조절할 것 같지는 않다??. ??쥐와 박쥐는 비슷한 대사속도를 가지고 있지만 수명은 ??5??배에서 ??10??배정도 다르다??. ??이는 노화를 조절하는 ??genetic response ??역 할을 시사한다??. ??또한 ??werner’s syndrome(??조로증??)??을 유발하는 유전자가 ??DNA helicase??인 것으로 최근 밝혀 져 있는데??(science, 272, 258), ??이러한 사실들로 미루어 볼때 ??metabolism-generated DNA damage??에 대한 ??genetic response??가 노화의 속도를 결정할 것이다??. ??
그렇다면 ??response??의 실체는 무엇일까???
3. ??세포노화와 유전자 발현 노화세포에서 세포주기 조절 유전자들의 발현을 보고하는 많은 논문들이 발표되고 있다??. ??증식 정지기에 있 는 세포??(Go)??와 노화 세포를 증식 자극인자로 처리 한 후 세포주기 유전자들의 발현을 비교하면 노화세포의 특징적인 유전자 발현을 조사할 수 있다??. ??두 종류의 세포에서 증식 자극 후 공통적으로 ??H-ras, c-jun, jun B ??등의 발현이 나타났으나 노화세포에서는 ??c-jun??의 발현이 유도되지 않았다??. ??그러므로 ??c-jun??의 발현을 억제 하는 인자가 노화세포에서 발현되고 있다고 볼 수 있다??. ??최근에는 ??differential screening??법을 이용하여 어 린세포와 노화세포의 유전자 발현을 정량적으로 분석할 수 있게 되었다??. ??이 방법에 의해서 ??AP1 (activator protein 1), CREBP (cAMP response element binding protein), ID1, ??및 ??ID2 (inhibitor of DNA binding)??의 전사활성이 노화의 진행에 따라 감소하는 것이 밝혀졌다??. ??그러나 이들 전사인자의 활성 감소가 세포노화의 원인인지 노화의 결과인지는 아직 명확하지 않다??. ?
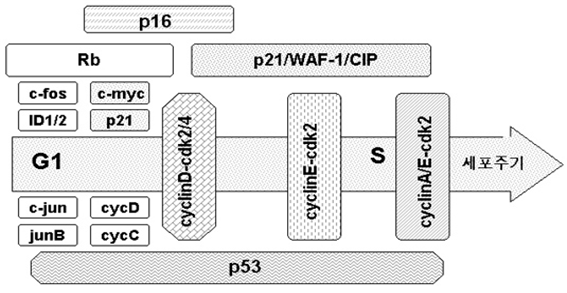 ?
???그림 ??2. ??노화세포의 특징적인 세포주기 관련 유전자의 발현??. ??
노화섬유아세포를 증식 자극후 유전자 발현의 변화를 나타낸다??.
4. ??세포노화와 ??Telomere ??염색체 말단의 불완전한 ??DNA??복제가 세포증식 능력의 감소를 초래하고 세포노화를 유발한다는 가설이 ??1973 ??년 ??Olovnikov ??등에 의하여 발표된 이래 염색체 말단구조와 세포노화의 관련성에 관한 많은 연구가 수행되 어 왔다??. ??
염색체 말단??, ??즉 ??telomere??는 ??repeated sequence??로 구성되어 있으며 염색체의 분해 및 다른 염색체 와의 결합으로부터 자신의 염색체를 보호하는 기능을 가지고 있다??. ??염색체 말단구조의 상실이 세포노화와 관련이 있다는 최초의 실험적 증거는 ??1990??년 ??Harley ??등에 의하여 발표되었다??.
Harley ??등은 인체배양 ??fibroblast??의 ??terminal restriction fragement(TRF)??의 길이가 세포분열의 회수에 따라 감소하는 것을 발견 하였다??. ??또한 노인으로부터 분리한 ??fibroblast??와 혈액세포의 ??TRF??의 길이가 어린이의 세포의 ??TRF??보다 짧다??. ??그러나 ??in vitro??에서 불멸화된 세포와 암세포는 세포분열을 계속해도 ??Telomere??의 길이가 감소되지 않았다??. ??이러한 결과는 인체의 정상세포가 세포분열 즉 ??DNA ??복제를 계속할수록 ??telomere??의 길이가 감소하며??, ??결국 세포가 ??telomere??의 단축된 길이를 감지하고 세포분열을 중지시켜서 세포노화를 초래할 것을 시사한다??. ??불멸 화된 세포는 염색체 말단??, telomere??의 길이를 안정적으로 유지하기 위하여 ??telomerase??의 높은 활성이 필수 적인 것일 것이다??. ??이러한 ??telomere ??가설은 정상세포의 세포분열과 노화를 연결하는 중요한 분자기작을 제 시한다??. ??그러나 활발한 후속연구의 결과들은 기존의 모델을 더욱 복잡하게 만들어 가고 있다??. telomrease??의 결손을 가지는 불멸화된 세포주가 발견되었고??, ??불멸화된 ??B, T??세포를 ??telomerasae??의 활성 저해를 유도해도 세포의 불멸화 상태에 아무런 영향을 주지 않았다??. ??또한 정상세포에서도 ??telomerase??의 발현이 발견되었고??, ??이들 세 포는 세포분열에 따라 ??telomere??의 길이가 감소했다??. ??체세포 융합에 의한 ??hybrid??에서 노화와 ??telomerase??의 활성은 서로 관련이 없었다??. ??최근 ??holiday ??등은 ??telomere ??가설을 조정할 수 있는 실험결과들을 발표하였다??.
??세포분열에 의하여 탄생한 두 개의 ??daughter ??세포가 서로 다른 수준의 증식능력을 가질수있으며 실험적인 조작에 의하여 인체 ??fibroblast??의 ??life span??을 향상시킬 수 있다는 것이다??. ??그럼에도 불구하고 ??telomere??가설은 현재 가장 유력 한 모델로서 ??mitotic clock??의 분자적 이해의 기초를 제공한다??.
5. ??세포노화와 암 억제 유전자 암 관련 유전자가 세포의 노화에 어떤 영향을 미치는 것일까??? ??
암과 노화란 전혀 관련성이 없어 보이지만 사 실은 동전의 앞??·??뒷면과 같은 관계에 있다??. ??암 세포가 무한증식 하기 위해서는 세포의 유한증식을 지배하 는 세포 노화 프로그램을 무시해야만 한다??. ??암 발생과정에서 정상세포의 불멸화 ??(immortalization)??과정이 바로 이런 노화 프로그램으로부터 벋어나기 위한 과정이다??. ??세포의 불멸화 과정에는 다양한 암 관련 유전자 가 작용하는 것이 밝혀져 있다??. ??
따라서 ??oncogene??의 일부는 노화 프로그램을 해체하는 작용을 할 것으로 보 인다??. p53 ??및 ??RB ??등의 항암유전자는 많은 암세포에서 변이 등에 의하여 그 기능이 상실되어 있고??, ??암세포에서 과 발현시키면 세포의 증식 정지 혹은 세포사멸 ??(apoptosis)??을 일으킨다??. ??암세포는 세포의 정상적인 노화기작 의 지배를 받지않고 무한증식이 가능하다??. ??세포노화는 ??SV40 T??항원 등의 ??DNA tumor virus??의 유전자의 발현이 나 ??p53, Rb ??등의 항암유전자의 ??antisense DNA, ??혹은 인체암세포에서 고빈도로 발견되는 ??dominant-negative p53 mutant??에 의하여 지연될 수 있다??. ??
최근 필자의 연구실은 ??p53 ??항암 유전자가 암세포의 노화를 유도한다는 새로운 사실을 발견하였다??. p53 ??유전 자의 선택적인 발현 시스템을 구축하고 암세포에서 ??p53 ??유전자를 과발현 시킨 결과 세포주기의 정지에 이어 서 노화가 시작되는 것을 비가역적인 세포증식의 정지??, cdc2, cyclin A, B??의 발현감소??, p21/Waf1??의 발현유 도??, Rb??의 탈인산화??, ??β??-galactosidase marker??의 출현 등에 의하여 확인하였다??. ??이 결과는 ??p53 ??유전자가 암 세포에서 작동하지 않고 있는 노화 프로그램을 자극하여 활성화 하여 이미 수명을 초과한 암세포를 노화시 키는 것으로 보인다??. ?
?
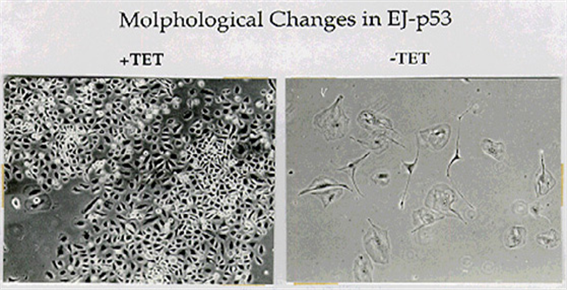
그림 ??3. p53 ??유전자의 선택적 발현에 의한 암세포의 노화??.
(+)tetracyclin ??조건하에서는 ??p53 ??유전자를 발현 하지 않고 정상적으로 성장하지만 ??(-)tetracyclin ??조건하에서 ??p53 ??유전자가 발현되고 세포주기 정지와 함 께 노화가 시작된다??(Shin et al., Proc. Nat'l. Acad. Sci. USA, 94, 9684). 6. ??세포노화와 세포주기 세포의 노화는 세포주기 ??G1??기에서 정지한 후 아직 알려지지 않는 다른 종류의 신호전달계와 협력하여 비가 역적인 증식 정지와 동시에 노화기로 들어갈 것으로 보인다??. ??대부분의 노화 세포에서는 ??G1 cyclin-cdk complex??의 활성이 억제되어 있고 증식 자극후에도 정지기의 세포와는 달리 이들 ??complex??가 활성화 되지 않 는다??. ??따라서 ??G1 cyclin-cdk complex??의 활성을 억제하는 시스템이 노화에 중요한 역할을 수행할 것으로 추 측해 볼 수 있다??. p21??의 발현은 세포분열이 한계수명에 가까워 질수록 증가하여 완전히 노화한 세포에서는 어린 세포보다 약 ??10-20??배 정도 많이 발현된다??. p21??의 발현은 ??p53??에 의하여 제어되기 때문에 ??p53??의 ??dominant negative ??변이를 도입했을 경우 세포분열의 한계수명이 연장된다는 결과는 ??p53??의 기능상실에 의 한 ??p21 ??발현의 감소때문일 것이다??. ??최근 ??p21 ??유전자를 ??knock out??시킨 세포에서 세포수명의 연장이 보고되었 다??. ??따라서 ??p21??의 발현이 노화의 진행에 중요한 인자임에는 틀림없다??. ??그러나 ??p21??의 발현증가가 이미 알려 진 것처럼 ??cyclin E/D-cdk2/4??의 활성감소와 ??Rb??의 탈인산화로 이어지는 일련의 ??cascade??에 의한 것인지 혹은 다른 경로의 미지의 인자들이 관여하는 것인지는 명확하지 않다??. ??그러나 최근 ??Rb??의 발현이 세포노화를 유도 할 수 있다는 보고가 계속 발표되고 있기 때문에 적어도 ??Rb??를 매개로 하는 경로가 노화의 진행에 관여하는 것은 사실인 것 같다??. p21??과 같이 ??cyclinD-cdk4 ??복합체의 활성을 저해하는 ??p16??의 역할도 주목된다??. p16??의 발현도 노화의 진행에 비례해서 증가힌다??. ??
세포노화 연구의 전망
인체는 분열세포와 비분열세포로 구성되어 있고 이들의 성질과 변화에 따라 인체의 노화가 진행될 것이다??. ??뇌세포와 신장세포 등의 비분열세포의 상실 혹은 기능저하는 생명을 위협하는 주요 요인이다??. ??따라서 비분 열조직으로 구성되어 있는 선충??(c. eleganse)??과 초파리의 수명연장 변이체의 분자 유전학적 분석은 노화 연 구의 중요한 전환점을 제공해 줄 수 있을 것이다??. ??한편 조직의 기능저하는 그들을 구성하는 분열세포의 기능저하와 관련이 있다??. ??
최근 유전적 조로를 유발하는 ??werner??′??s syndrome??의 유전자가 발견되어 ??DNA helicase??인 것으로 밝혀졌다??. ??세포주기를 제어하는 시스템과 노화와의 관련성에 중요한 단서를 제공하고 있 다??. ??세포의 불멸화 과정에 관여하는 적어도 ??4??종류의 ??M2??기 유전자의 실체가 밝혀지면 세포노화를 이해하는데 중 요한 계기가 될 것으로 기대된다??. ??노화에 다른 신체기능의 저하와 노화 관련 질환의 대부분은 세포의 비정 상적인 노화의 결과로서 나타나는 퇴행성 기능변환이 원인일 것으로 생각된다??. ??따라서 노화 프로그램의 분 자적 실체가 규명되면서 이러한 신체기능의 장애와 질환을 예방할 수 있는 지식이 생겨날 것을 기대해 본다??. ?
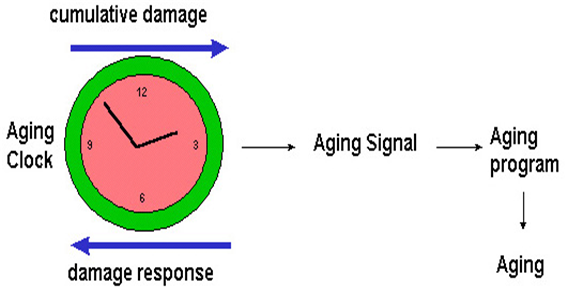
? ??그림 ??4. ??노화의 가설??.
??인체 내에 존재하는 노화시계??(Aging clock)??는 ??damage??의 축적과 ??damage??를 해소하는 ??damage response??의 평형에 의하여 조절되고 이 신호는 세포증식을 조절하는 시스템에 전달될 것이다??.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 세포 노화의 분자메카니즘.hwp
세포 노화의 분자메카니즘.hwp