BioINdustry
(BioIN + Industry) : 바이오 산업별 시장현황 및 전망정보 제공유전자편집 기술의 글로벌 시장 현황 및 전망
- 등록일2023-12-08
- 조회수20039
- 분류생명 > 생명과학, 생명 > 생물공학
-
발간일
2023-12-08
-
키워드
#유전자 편집 시장#유전자가위 기술#유전자편집 치료제
- 첨부파일
-
차트+
?
차트+ 도움말
[BioINdustry No.187] 유전자 편집 기술의 글로벌 시장 현황 및 전망
국가생명공학정책연구센터 연구원 이현희
※본 보고서는 프로스트앤드설리번에서 발간한 보고서 ‘Advances in Gene Editing Technologies in Healthcare, 2023’, ‘Growth Opportunities in Gene Editing Technologies, Advanced Biomanufacturing, Drug Discovery and Precision Medicine, 2022‘, Markets and Markets에서 발간한 보고서 ’Gene Editing Market, Global Forecast to 2028 등을 종합적으로 참고하여 국가생명공학정책연구센터에서 재구성한 것임
◈ 목차
요약문
1. 유전자편집 기술 개요
1) 정의 및 범위
2) 연구개발 동향
3) 유전자편집 시장 개요
2. 유전자편집 시장 분류 및 전망
1) 기술 기준, 글로벌 시장 분류 및 전망(2022~2028)
2) 응용분야 기준, 글로벌 시장 분류 및 전망(2022~2028)
3) 최종 사용자 기준, 글로벌 시장 분류 및 전망(2022~2028)
4) 제품 및 서비스 기준, 글로벌 시장 분류 및 전망(2022~2028)
5) 지역별 유전자편집 시장 전망(2022~2028)
3. 주요 기업 동향
1) 시장 점유율 분석(2022)
2) 4분면(Quadrant) 분석을 활용한 상위 15개 기업 평가(2022)
3) 주요 기업 유전자편집 치료제 임상 현황
4. 성장 전략
1) 성장동인, 억제 및 기회 요인
【요약문】
□ 글로벌 유전자 편집 시장은 2023년 53억 2,061만 달러에서 연평균 15.0%로 성장하여 2028년 106억 8,474억 달러 규모가 될 것으로 전망
○ 기술을 기준으로 2022년 크리스퍼 분야가 29억 9,538만 달러로 전체시장(46억9,226만 달러)의 63.8%를 점유하며 가장 큰 시장을 형성

출처 : Markets and Markets, Gene editing market, 2023.6, 국가생명공학정책연구센터 재가공
[그림1] 글로벌 유전자편집 시장 전망
╶︎응용분야를 기준으로 세포주 엔지니어링(31%), 최종 사용자 기준으로 제약·생명공학기업(41.5%), 제품 및 서비스를 기준으로 시약 및 소모품(55.6%) 분야가 2022년 기준 가장 높은 점유율을 차지
╶︎가장 큰 시장을 차지하는 지역은 북미로 2022년 46.9%를 점유하며 시장을 주도하나 아시아·태평양 지역이 연간 성장률 15.7%로 가장 빠르게 성장
○ 최초 크리스퍼 치료제 승인, 투자·협력 증가, 응용 범위 확대 및 유전자편집 기술의 빠른 발전, 현장진단 수요 증가로 빠른 성장을 전망
╶︎영국은 CRISPR-Cas9 적용 치료제 ‘카스게비’를 세계 최초로 승인 (2023.11.16.)
╶︎높은 치료 비용, 비표적 효과에 의한 돌연변이 가능성, 체내(In vivo) 효율적 운반 시스템 부재는 시장 성장 및 치료 접근성을 제한
◈본문
1. 유전자편집 기술 개요
1) 정의 및 범위
□ 유전자편집 기술은 생명체의 유전체에서 표적 DNA를 삭제·삽입·치환하여 정상 기능을 복원하거나 더 나은 형질로 개량하는 기술
○ 표적 DNA 염기서열을 인식하는 부분과 절단하는 효소로 구성된 유전자가위 기술의 발전이 매우 중요
╶︎1세대 징크핑거(1996년), 2세대 탈렌(’10년), 3세대 크리스퍼 캐스9(’12년), 차세대 유전자가위 순으로 편집의 정확도, 효율성, 안전성 및 응용 범위 증가로 이전 기술의 한계를 극복하며 발전 중
○ 유전자편집 기술은 인류가 직면한 질병, 기후변화, 식량, 환경, 에너지 등의 문제를 해결하는 혁신적 범용 기술로 자리매김
╶︎(녹색농업·기후 탄력성 작물) 기후변화를 늦추거나 기후 탄력성 작물 개발
╶︎(바이오 연료) 주원료인 곡물의 종자를 개량하거나 발효 균주 개량
╶︎(동·식물 육종) 전통 육종법 대비, 더 나은 품종 개발에 걸리는 시간을 1/4로 단축
╶︎(이종장기) 면역거부 유전자를 제거한 동물의 장기를 인간에게 이식
╶︎(감염병 제어) 감염성 질환에 대한 감수성이 낮아지도록 유전자를 편집
╶︎(난치·유전질환 치료제) 질병 원인 유전자를 직접 제거하거나 교정하여 정상 기능을 복구하는 치료용 유전자편집기술 기반의 바이오 의약품
※︎영국 의약품 규제청이 CRISPR-Cas9을 활용한 Ex-vivo 세포 치료제, ‘카스게비(미국 상품명 : 엑사셀)’를 세계 최초로 승인(2023.11.16.)
○ 유전체 편집 방법은 체외(ex-vivo) 편집과 체내(in-vivo) 편집으로 구분
╶︎체외 편집은 체외에서 배양이 가능하고, 체내로 재주입 시, 원래의 기능을 유지할 수 있는 세포에 한정되어 있어 줄기세포, 조혈모세포, 면역세포를 포함한 혈구 세포에만 적용 가능한 점이 한계
╶︎그러나, 대부분의 유전질환들은 체외 편집이 불가능하여 체내 편집 방법으로 치료해야 하며 효율적인 체내 전달 기술의 개발이 필요한 상황
[표1] 1~3세대 및 차세대 유전자가위
| 유전자가위 모식도 | 편집방식 | 특 징 |
1세대 징크핑거 뉴크레아제 (ZFN) |
| 삭제 knock-out | - (구성) 징크핑거 단백질(표적 DNA 염기서열 인식) + FokI(DNA 이중나선 절단) - (장점) 높은 표적 특이성, 생체 내(In-vivo) 전달 용이 - (단점) 고비용, 복잡한 설계·제조 |
2세대 탈렌 (TALEN) |
| 삭제 knock-out | - (구성) 탈렌 단백질(표적 DNA 염기서열 인식) + FokI(DNA 이중나선 절단) - (장점) 높은 표적 특이성, 용이한 생체 내(In-vivo) 전달 - (단점) 고비용, 복잡한 설계·제조 |
3세대 크리스퍼 캐스9 (CRISPR-Cas9) |
| 삭제 knock-out | - (구성) guide RNA(표적 DNA 염기서열 인식) + Cas9(DNA 이중나선 절단) - (장점) 저비용, 간편한 설계·제조 - (단점) 생체 내(In-vivo) 전달의 어려움, 비표적 활성 |
차세대 염기편집 (Base editor) |
| 치환 substitution | - (구성) guide RNA + dCas9*+탈아미노 효소 - (장점) DNA 절단 없이 단 하나의 염기만 치환하여 안전 - (단점) A(아데닌)과 C(사이토신)2개 염기만 편집 가능 * D10A, H840A 2곳 활성부위 억제로DNA 절단 기능이 결여 |
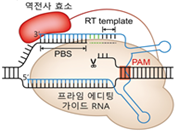
차세대 프라임 편집 (Prime editor) |
| 삽입 knock-in | - (구성) peg RNA(gRNA+주형RNA)+ nCas9*+ 역전사 효소 - (장점) DNA 단일가닥만 절단하여 정확·효율적으로 표적 위치에 새로운 염기서열 삽입 - (단점) 최대 90개 이내의 염기만 삽입 가능 * D10A 돌연변이로 Cas9 한 곳의 활성부위 억제로 한 가닥 DNA 만 절단 |
차세대 피기백 (PiggyBac) |
| 삽입 knock-in | - (구성) 트랜스포존+트랜스포존 절단효소*(transposase) - (장점) 효율적인 형질전환·유전자 삽입 - (단점) 돌연변이 유발 가능성 * 트랜스포존 양쪽 말단의 IR(inverted repeat)을 인식 절단 후, 결합하여 유전체내 특정 위치에 Transposon을 삽입 |
차세대 인테그라제 (Integrase) |
| 삽입 knock-in | - (구성) 프라임편집+세린 인테그라제* - (장점) 정확하고 효율적인 유전자 삽입, 최대 36kb까지 삽입 가능 - (단점) 복잡한 설계 * attP,attB 특이적 유전자 재조합 효소로 특정 위치에 유전자를 삽입 |
출처 : Advances in Gene Editing Technologies in Healthcare, 2023. 국가생명공학정책연구센터 재가공
□ 체내유전자편집치료제 개발을 위해 바이러스성 벡터와 물리화학적인 비바이러스성 벡터를 개발
○ 바이러스성 벡터는 체내‧외 모두에서 가장 널리 사용되는 전달체
╶︎체내 유전자편집 치료제의 최적 전달기술로 AAV*(Adeno-associated virus)가 주목 받고 있으나 탑재 가능한 유전자 크기 제한(4.7kb 이내)이 한계
⁎︎외피 비보유(non-enveloped) 바이러스로 다양한 조직에 대한 표적 특이성을 가짐. 비병원성 바이러스로 면역원성이 매우 낮고 벡터 설계가 용이하며 장기간 지속 발현
[표2] 바이러스성 전달체
전달체 | 형 태 | 전달 크기 | 장 점 | 단 점 |
AAV (Adeno- associated virus)
| Basic (아데노 연관 바이러스) | 4.7Kb | · 지속적 발현 · 낮은 면역원성 | · 유전자 크기 제한성 · 돌연변이 유발 가능성 |
Dual (아데노 연관 바이러스 이중 벡터) | 4.7Kb | · 정확한 유전자 교정 * AAV-1:gRNA+HDR 복구용 주형, AAV-2: Cas9 · 낮은 면역원성 | · 편집 효율성 감소 * 2개 벡터를 표적세포에 모두 유입이 필요
| |
All-in-One (올인원 아데노 연관 바이러스) | 4.7Kb | · sgRNA와 소형 Cas9으로 유전자 크기 감소 · 이중 벡터 대비 안전성, 편집 효율성 증가 | · 돌연변이 유발 가능성
| |
Engineered (유전자 변형 아데노 연관 바이러스) | 30Kb 이상 | · 30Kb 이상의 유전자 삽입 용량 * 모든 바이러스 유전자 제거로 30 kb 이상 유전자 삽입 가능 | · 조혈모세포와 면역세포 특이적 벡터
| |
Self-inactive (자가 비활성화 아데노 연관 바이러스) | 4.7Kb | · 돌연변이·면역원성 감소 * Cas9 gRNA가 체내 Cas9 단백질 제거를 유도 | · 유전자 크기 제한성
| |
AV (Adeno virus)
| Basic | 7.5Kb | · 높은 전달 효율
| · 강한 면역반응
|
LV (Lenti virus)
| Basic | 8Kb | · 대상세포에 따라 발현조절 가능 | · 세포독성 · 돌연변이 유발 가능성
|
Herpes simplex virus | Basic | 20Kb | · 중추 신경계 특이적 벡터 · 유전자 삽입 용량
| · 유전자 조작의 어려움
|
출처 : Advances in Gene Editing Technologies in Healthcare, 2023. 국가생명공학정책연구센터 재가공
○ 비바이러스성 벡터는 쉬운 제조법, 낮은 면역원성, 탑재 가능한 유전자 크기 무제한 등의 장점이 있지만 낮은 전달 효율과 전달 가능한 조직의 제한이 한계
╶︎LNP 기술이 가장 많이 이용되나 간 조직에만 전달 가능한 한계점 보유
[표3] 비 바이러스성 전달체
전달체 | 종 류 | 장 점 | 단 점 |
Lipid-based Formulations (지질 기반 제제)
| LNP/Liposome (지질나노입자/리포좀)
Dendrimer LNP (합성 고분자 LNP) | · 양이온성 지질로 구성 · 낮은 항원성 · mRNA, RNP 전달에 유망 · 기업:Recode therapeutics | · 낮은 전달 효율 · 단기간 발현
|
Cell component- derived Carriers (세포 성분 유래 담체)
| Exosome(엑소좀) | · 장거리 운송 용이 · 우수한 생체 적합성 · 비표적 효과 감소 | · 대량 생산 어려움 · 고순도 엑소좀 분리 어려움
|
Virus-like Particles(VLPs) (바이러스 유사 입자) | · 비감염성(낮은 면역원성) · 다양한 조직 표적화 · 높은 전달 효율
| · 고비용 · 정제와 대량 생산 어려움
| |
Polymer- based Formulation (폴리머 기반 제제)
| Polymer-based Nanoparticles (합성 고분자 나노입자) | · 우수한 생체 적합성 · 구조, 크기, 이온화 특성, 등 맞춤 설계 가능 · 기업: Gene Edit | · 낮은 전달 효율 · 단기 발현
|
CPPs(Cell Penetrating Peptides) (세포 투과성 펩타이드) | · 강력한 세포 투과능 · 난투과성 약물에 적용 가능 · 기업: Spotlight 테라퓨틱스 | · 세포 비특이성 · 낮은 타겟 특이성
| |
Nanoparticles (나노입자)
| CRISPR Gold Technology (크리스퍼 골드기술) | · 낮은 생체 독성 · 높은 표적 지향 효과 · 개발자: 캘리포니아대 | · 높은 제조 비용
|
Peptide-based Nanoparticles (펩타이드 나노입자) | · 높은 세포 특이성 · 낮은 제조 비용 · 기업: Ligandal Inc. | · 낮은 구강 투여 효용성 · 혈액 순환 중의 불안정성
| |
Pysical Delivery (물리적 전달)
| Electroporation (전기천공법) | · 우수한 전달효율 · 단백질 도입 가능 · 기업: NAVAN Tech. Inc. | · 도입 부위 세포·조직 손상
|
Microfluidic Vortex shedding (미세유체 와류 발산) | · 전기천공법 보다 우수한 전달효율 · 높은 범용성 · 개발자: Indee Labs | · 미세유체 장치 제작의 어려움
|
출처 : Advances in Gene Editing Technologies in Healthcare, 2023. 국가생명공학정책연구센터 재가공
2) 연구개발 동향
□ 유전자가위 기술 역량이 핵심으로 전 세계적으로 R&D 및 특허 경쟁이 심화되고 있는 분야 중 하나
○ 국가별 R&D 역량 분석
╶︎(1999년~2021년 1월)까지, 출간된 유전자편집 관련 13,980건의 논문을 대상으로 선도국가, 영향력 있는 기관, 경쟁과 협력에 관한 계량 서지학적 분석
○ 의학, 농업, 산업 분야별 유전자편집 기술 연구 동향
╶︎의학 분야가 논문 산출량이 가장 많고, 농업 분야는 논문 산출량은 적지만 증가율이 가장 높은 분야

[그림2] 의학, 농업, 산업 분야별 논문 산출량 (1999~2021)
출처 : Cells, The Bibliometric Ladscape of Gene Editing Innovation and Regulation in the Worldwide, 2022,11
○ 논문 산출량 및 평균 피인용 수로 본 R&D 역량 상위 20개국 연구 성과 분석
╶︎(미국) 논문 수 1위, 평균 피인용 횟수 2위로 선두 국가
╶︎(중국) 논문 수 2위, 평균 피인용 횟수 12위로 논문 산출량 대비 연구 영향력이 낮은 편
╶︎(잠재력국가) 논문 수와 피인용 횟수를 종합적으로 평가한 결과 독일, 한국, 프랑스가 유전자편집 분야에서 발전할 잠재력이 높은 국가
╶︎스웨덴은 전체 논문 수가 208편에 불과하나 평균 피인용 횟수는 84.28회로 전체 평균 보다 2.6배 높아 연구 영향력이 큰 국가로 분석
※︎한국은 논문 수 6위(558건), 평균 피인용 횟수 6위(31.29회)를 차지

[그림3] R&D 역량 상위 20개국 연구성과 분석(1999~2021)
(A) 논문 및 평균 피인용 지수 버블 차트, (B) 국가 협력 네트워크
출처 : Cells, The Bibliometric Ladscape of Gene Editing Innovation and Regulation in the Worldwide, 2022,11
○ R&D 역량 상위 20개국의 국제적 경쟁과 협력 기여도
╶︎(미국) 국제 연구 협력에 가장 큰 기여를 하고 있으며, 일본, 독일, 영국과 주요하게 국제 협력 관계를 맺고 있음
╶︎영국, 일본, 독일은 국제 연구 협력 네트워크에서 상대적으로 중요한 중심점(node)
╶︎중국은 미국, 독일과 주요 협력 관계를 맺고 있으며 논문 산출량에서 2위를 차지하고 있지만 늦은 시작, 정책 제한, 농업에 대한 집중 등의 요인으로 전반적 기여도는 중간 수준
○ R&D 역량 상위 10개 연구기관
╶︎논문 산출량 1위 기관은 중국과학원으로 총 910건을 출간했지만 평균 피인용 횟수는 9위로 많은 논문 산출량 대비 연구 영향력은 낮은 기관
╶︎하버드대와 MIT는 논문 수로는 4위, 7위에 해당하나 평균 피인용 횟수는 가장 높아 논문 산출량 대비 연구 영향력이 가장 높은 기관
╶︎서울대학교는 논문 수 10위, 평균 피인용 횟수 4위로, 논문 수 대비 연구 영향력이 높은 편에 속하는 기관
[표4] R&D 역량 상위 20개국 연구 성과 분석(1999~2021)
순위 | 기 관 | 논문 수 | 평균 피인용 횟수 |
1 | 중국 과학원(Chinese Academy of Sciences) | 910 | 34.21 |
2 | 하버드 의대(Harvard Medical School) | 291 | 40.3 |
3 | 스탠포드대(Stanford University) | 265 | 46.75 |
4 | 하버드대(Harvard University) | 251 | 280.71 |
5 | UC 버클리(University of California, Berkeley) | 220 | 118.13 |
6 | 중국 농업과학원(Chinese Academy of Agricultural Sciences) | 192 | 22.41 |
7 | 메사추세츠 공대(MIT) | 173 | 298.36 |
8 | UC 샌디에고(University of California, San Diego) | 160 | 39.74 |
9 | UC 샌프란시스코(University of California, San Francisco) | 155 | 54.07 |
10 | 서울대(Seoul National University) | 153 | 70.65 |
출처 : Cells, The Bibliometric Ladscape of Gene Editing Innovation and Regulation in the Worldwide, 2022,11
○ R&D 역량 상위 5위 연구자
╶︎전체적으로 상위 1~5위 연구자의 논문 수는 큰 차이가 없으나 피인용 횟수의 차이는 커서 연구자별 연구 영향력의 차이는 큰 것으로 분석
╶︎피인용 횟수가 가장 많은 연구자는 펭장으로, 평균 피인용 횟수가 589회로 동료 연구자들로부터 지속적으로 인정을 받아 온 가장 영향력 있는 연구자
╶︎그 뒤로 제니퍼 다우드나(280회), 김진수(153회) 순으로 영향력 있는 연구자
[표5] R&D 역량 상위 5위 연구자 분석(1999~2021)
연구자 | 논문 수 | 평균 피인용 횟수 | 최근 3년 비율 | 기관 |
타카시 야마모토(Takashi Yamamoto) | 69 | 27.04 | 20% | 히로시마대 |
테츠시 사쿠마(Tetsushi Sakuma) | 62 | 28.44 | 19% | 히로시마대 |
펭장(Feng Zhang) | 62 | 589.1 | 25% | MIT |
김진수(Jin-Soo Kim) | 61 | 153.34 | 24% | 서울대 |
제니퍼 다우드나(Jenifer A Doudna) | 52 | 280.65 | 44% | UC 버클리 |
출처 : Cells, The Bibliometric Ladscape of Gene Editing Innovation and Regulation in the Worldwide, 2022,11
3) 유전자편집 시장 개요
□ (전체시장)글로벌 유전자편집 시장은 2023년 53억 2,061만 달러에서 연평균 15.0%로 성장하여 2028년 106억 8,474억 달러 규모가 될 것으로 전망
○ 현장진단 수요 증가, 정부·민간 투자 증가 및 연구 프로젝트 수 증가, 기술의 응용 범위 확대 및 CRISPR-Cas9 도입 등 유전자편집 기술의 빠른 발전 및 최초 크리스퍼 치료제의 시장 진출은 시장 성장을 촉진
╶︎높은 치료 비용, 비표적 효과(off-target effect)에 의한 돌연변이 유발 가능성 등 기술 안전성 문제, 체 내(in vivo) 효율적 운반 시스템 부재는 시장 성장을 저해
╶︎CRISPR-Cas9 기술 적용 치료제, 카스게비(미국상품명: 엑사셀)가 영국에서 최초로 의약품 승인, 미국 FDA·유럽 의약품청은 연내 승인을 전망
╶︎그 외, 다수의 크리스퍼 기술 적용 치료제가 임상에 진입하면서 향후 신약 출시로 빠른 시장 성장을 전망
○ 기술, 응용 분야, 최종 사용자, 제품·서비스를 기준으로 시장을 분류하며 세부 분류는 [표 6]과 같음
[표 6] 유전자편집 시장 분류
|
|
|
|
|
| |
기술 (Technology) |
| 응용분야 (Application) |
| 최종 사용자 (End user) |
| 제품·서비스 (Product&Service) |
↓ |
| ↓ |
| ↓ |
| ↓ |
크리스퍼 (CRISPR) |
| 세포주 엔지니어링 |
| 제약·생명공학 기업 |
| 시약·소모품 |
↓ |
| ↓ |
| ↓ |
| ↓ |
탈렌 (TALEN) |
| 유전자 엔지니어링 |
| 대학·연구기관 |
| 소프트웨어·시스템 |
↓ |
| ↓ |
| ↓ |
| ↓ |
징크핑거 뉴클레아제(ZFN) |
| 약물 발굴·개발 |
| 기타 (진단회사, 병원) |
| 서비스 |
↓ |
| ↓ |
|
|
|
|
안티센스 (Antisense) |
| 기타 (진단,바이오연료,법의학) |
|
|
|
|
↓ |
|
|
|
|
|
|
기타 (차세대 유전자가위) |
|
|
|
|
|
|
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
2. 유전자편집 시장 분류 및 전망
1) 기술 기준, 글로벌 시장 분류 및 전망(2022~2028)
□ 2022년 CRISPR-Cas9 기술이 29억 9,538만 달러로, 전체 시장(46억9,226만 달러)의 63.8%를 점유하며 가장 큰 시장을 형성
○ CRISPR-Cas9(63.8%), 탈렌(15.7%), 기타(7.6%), 징크핑거(6.6%), 안티센스(6.1%) 순으로 시장을 형성
╶︎CRISPR-Cas9 기술은 저비용 가장 간편한 설계·제조·조작으로 유전자 편집 시장의 혁신과 성장을 견인
⁎︎※ CRISPR-Cas9은 염기서열을 인식하는 RNA만 교체하면 다양한 유전자를 타겟할 수 있어 전 세계 수 많은 실험실에서 다양한 동·식물, 미생물의 유전자 교정 도구로 널리 사용
⁎︎※ 이를 두고 2010년대 초반까지 소수 연구자들만 과점하던 유전체 교정법이 CRISPR-Cas9에 의해 민주화되었다고 평하기도 함
╶︎안티센스*는 별도의 발현 벡터 제작 없이 LNP로 체내 도입 가능, 표적 적용 용이한 장점으로 향후, 가파른 성장세가 예상되며 2022년 기준 6.1%의 시장을 형성
⁎︎15~100개 뉴클레이타이드로 구성된 단일 가닥 RNA로 표적 mRNA 결합하여 분해함으로써 발현을 억제하는 유전자 치료제
○ 가장 큰 시장을 형성한 국가는 미국으로, 2022년 기준 19억 8,968만 달러의 규모로 전체시장의 42.4%를 점유하며 시장을 주도
╶︎그 뒤로, 중국(8.2%), 독일(5.7%), 일본(5.4%), 캐나다(4.5%) 순으로 시장을 형성
╶︎한국은 6,570만 달러의 시장 규모로 전체 시장의 1.4%를 점유

[그림 4] 기술 기준 글로벌 유전자 편집 시장 분류 및 전망, 2023vs2028
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6,
[표 7] 기술 기준, 글로벌 유전자 편집 시장 규모, 2022~2028(MUSD)
기술 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
크리스퍼 | 2,995.38 | 3,414.47 | 3.905.83 | 4,487.45 | 5,180.37 | 6,018.70 | 7,037.93 | 15.6% |
탈렌 | 738.40 | 841.34 | 962.01 | 1.104.79 | 1,274.86 | 1,480.56 | 1,730.59 | 15.5% |
징크핑거 | 312.20 | 338.25 | 366.96 | 398.88 | 434.50 | 474.92 | 520.73 | 9.0% |
기타 | 355.98 | 400.93 | 453.11 | 514.29 | 586.51 | 673.12 | 777.48 | 14.2% |
안티센스 | 290.29 | 325.62 | 366.48 | 414.22 | 470.35 | 537.45 | 618.01 | 13.7% |
총합 | 4,692.26 | 5,320.61 | 6,054.63 | 6,919.63 | 7,946.59 | 9,184.76 | 10,684.74 | 15.0% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
[표 8] 2022년 기술 기준 국가별 시장 규모(USD Million)
국가 | 미국 | 중국 | 독일 | 일본 | 캐나다 | 기타 | 총합 |
크리스퍼 | 1,269.42 | 246.76 | 171.80 | 164.06 | 134.83 | 1,008.51 | 2,995.38 |
탈렌 | 312.38 | 60.93 | 42.32 | 40.53 | 33.19 | 249.05 | 738.40 |
징크핑거 | 135.30 | 25.19 | 18.09 | 16.64 | 14.28 | 102.70 | 312.20 |
기타 | 150.22 | 29.44 | 20.38 | 19.60 | 15.97 | 120.37 | 355.98 |
안티센스 | 122.37 | 24.03 | 16.61 | 16.00 | 13.02 | 98.26 | 290.29 |
총합 | 1,989.69 | 386.35 | 269.20 | 256.83 | 211.29 | 1,578.89 | 4,692.26 |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
2) 응용분야 기준, 글로벌 시장 분류 및 전망(2022~2028)
□ 2022년 세포주 엔지니어링 분야가 14억 5,632만 달러로, 전체 시장(46억9,226만달러)의 31%를 점유하며 가장 큰 시장을 형성
○ 세포주 엔지니어링(31%), 유전자 엔지니어링(26%), 약물 발굴 및 개발(10.7%) 순으로 시장을 형성
╶︎(세포주 엔지니어링) 정부·민간 투자 증가, 유전자 변형 줄기세포 치료법에 대한 인식 제고 및 IND 승인 건수 증가 등이 성장을 뒷받침
╶︎(유전자 엔지니어링) 개량된 형질을 갖는 동·식물 육종, 이종 장기, 유전질환 동물 모델 제작 등에서 활용이 증가
╶︎(약물 발굴 및 개발) CRISPR-Cas9 기반 핵산 진단법* 수요 증가, 다수 크리스퍼 기술 적용 치료제가 빠르게 임상에 진입으로 빠른 시장 성장이 예상
⁎︎CRISPR-Cas9이 병원균 유전자를 인식해 절단되면 발생하는 형광신호를 검출하는 원리
⁎︎※ PCR 진단법이 소량의 핵산을 명확히 검출하나 기술의 복잡성으로 실험실 내 검사로 제한되는 한계점 대비 저비용, 신속 정확, 휴대 가능한 핵산 기반의 진단을 제공으로 향후, 감염병 진단의 표준, 핵산기반 진단법은 CRISPR-Cas 기반 기술로 보편화될 것
⁎︎※ 영국 의약품 규제청은 세계 최초 CRISPR-Cas9 적용 세포치료제, ‘카스게비’의 의약품 판매를 승인, 미국 FDA와 EU 의약품청에서도 동제품 연내 승인을 전망
⁎︎※ SNP, NGS 기술, 유전체 데이터 분석(AI) 기술 등의 발달로 희귀(유전) 질병에 대한 표적 약물 발굴 및 치료제 개발의 효율성 증가

[그림 5] 응용 분야 기준 글로벌 유전자 편집 시장 분류 및 전망, 2023vs2028
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
[표 9] 응용 분야 기준, 글로벌 유전자 편집 시장 규모, 2022~2028(MUSD)
기술 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
세포주 엔지니어링 | 1,456.32 | 1,666.09 | 1.912.69 | 2,205.29 | 2,554.75 | 2,978.48 | 3,494.82 | 16.0% |
유전자 엔지니어링 | 1,219.39 | 1,385.14 | 1,579.00 | 1,807.92 | 2,079.98 | 2,408.42 | 2,806.82 | 15.2% |
약물 발굴·개발 | 499.10 | 570.02 | 653.29 | 751.98 | 869.72 | 1,012.34 | 1,185.94 | 15.8% |
기타 | 1,517.49 | 1,699.37 | 1,909.41 | 2,154.44 | 2,442.13 | 2,758.52 | 3,197.16 | 13.5% |
총합 | 4,692.26 | 5,320.61 | 6,054.63 | 6,919.63 | 7,946.59 | 9,184.76 | 10,684.74 | 15.0% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
3) 최종 사용자 기준, 글로벌 시장 분류 및 전망(2022~2028)
□ 2022년 제약·생명공학기업 분야가 19억 4,564만 달러로, 전체시장(46억9,226만 달러)의 41.5%를 점유하며 가장 큰 시장을 형성
○ 제약·생명공학기업(41.5%), 대학 및 연구기관(30.7%), 기타(진단회사, 소규모 CRO·CDMO)(27.8%) 순으로 시장을 형성
╶︎(제약·생명공학기업) 감염병 진단, 유전자 치료 등 다양한 응용 분야에서 제약사의 크리스퍼 기술의 활용이 증가하면서 가장 큰 시장 규모를 형성
╶︎(대학및연구기관) 정부의 유전자편집 연구 프로젝트 증가, 연구소와 유전자편집 제품 제조사 간의 공동연구 추세로 시장 성장이 예상
╶︎(기타) 최종 사용자로는 진단회사, 소규모 CRO 및 CDMO가 있고 유전체 의학, 동반 진단, 치료법 개발을 위해 진행 중인 임상연구, 줄기세포 기반 유전자 폅집 치료제에 대한 수요 증가로 성장이 예상

[그림 6] 최종 사용자 기준, 글로벌 유전자 편집 시장 분류 및 전망, 2023vs2028
[표 10] 최종 사용자 기준, 글로벌 유전자 편집 시장 규모, 2022~2028(MUSD)
기술 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
생명공학·제약 기업 | 1,945.64 | 2,213.25 | 2.526.53 | 2,896.83 | 3,337.36 | 3,869.66 | 4,515.94 | 15.3% |
대학· 연구기관 | 1,440.01 | 1,636.40 | 1,866.13 | 2,137.92 | 2,460.02 | 2,849.51 | 3,322.08 | 15.2% |
기타 | 1,308.03 | 1,470.97 | 1,661.73 | 1,885.34 | 2,149.20 | 2,465.59 | 2,846.71 | 14.1% |
총합 | 4,692.26 | 5,320.61 | 6,054.63 | 6,919.63 | 7,946.59 | 9,184.76 | 10,684.74 | 15.0% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6,
4) 제품 및 서비스 기준, 글로벌 시장 분류 및 전망(2022~2028)
□ 2022년 시약 및 소모품 분야가 26억 905만 달러로 전체 시장(46억9,226만 달러)의 55.6%를 점유하며 가장 큰 시장을 형성
○ 시약 및 소모품(24.8%), 소프트웨어 및 시스템(24.8%), 서비스(19.6%) 순으로 시장을 형성
╶︎시약 및 소모품의 반복적 구매, 유전자 편집 및 유전체학적 응용, 시퀀싱에 대한 수요 증가로 향후 시장의 성장을 전망
※︎시약 및 소모품에는 크리스퍼 라이브러리, 게놈 DNA 분리·정제 키트, 표적 DNA 시퀀싱 키트와 같은 다양한 제품이 포함
※︎DNA 및 RNA 시퀀싱, 마이크로어레이 분석, 유전형 및 유전자 발현 분석용 소프트웨어 및 시스템이 포함
※︎시퀀싱 및 데이터 분석 서비스가 포함

[그림7] 제품 및 서비스 기준 글로벌 유전자 편집 시장 분류 및 전망, 2023vs2028
[표 11] 제품 및 서비스 기준, 글로벌 유전자 편집 시장 규모, 2022~2028(USD Million)
제품·서비스 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
시약·소모품 | 2,609.05 | 2,961.91 | 3.374.35 | 3,386.13 | 4,439.41 | 5,137.19 | 5,983.23 | 15.1% |
소프트웨어·시스템 | 1,161.81 | 1,304.12 | 1,469.04 | 1,661.78 | 1,888.60 | 2,159.92 | 2,485.93 | 13.8% |
서비스 | 921.40 | 1,054.50 | 1,210.99 | 1,398.72 | 1,618.58 | 1,887.65 | 2,215.58 | 16.0% |
총합 | 4,692.26 | 5,320.61 | 6,054.63 | 6,919.63 | 7,946.59 | 9,184.76 | 10,684.74 | 15.0% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
5) 지역별 유전자편집 시장 전망(2022~2028)
□ 가장 큰 시장을 차지하는 지역은 북미로, 2022년 22억 97만 달러 규모로 전체 시장의 46.9%를 점유하며 시장을 주도
○ 북미(46.9%), 유럽(24.3%), 아시아·태평양(23.7%), 라틴아메리카(3.4%), 중동·아프리카(1.7%) 순으로 시장을 형성
╶︎연간 성장률 측면에서는 아시아·태평양 지역이 연간 성장률 15.7%로 가장 빠르게 성장하며 그 뒤로 유럽(15.4%), 북미(14.5%) 순으로 성장

[그림 8] 2022년 지역별 글로벌 유전자편집 시장 점유율 및 연간 성장률
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
[표 12] 지역별 글로벌 유전자 편집 시장 규모, 2022~2028(MUSD)
지역 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
북미 | 2,200.97 | 2,485.07 | 2.815.68 | 3,204.24 | 3,663.89 | 4,216.40 | 4,883.61 | 14.5% |
유럽 | 1,139.44 | 1,297.34 | 1,482.31 | 1,701.07 | 1,961.48 | 2,276.28 | 2,658.71 | 15.4% |
아시아·태평양 | 1,111.80 | 1,268.66 | 1,452.71 | 1,670.70 | 1,930.57 | 2,245.15 | 2,627.84 | 15.7% |
라틴 아메리카 | 160.99 | 181.48 | 205.30 | 233.26 | 233.26 | 305.94 | 353.77 | 14.3% |
중동·아프리카 | 79.06 | 88.05 | 98.38 | 110.37 | 124.36 | 140.98 | 160.80 | 12.8% |
총합 | 4,692.26 | 5,320.61 | 6,054.39 | 6,919.63 | 7,946.59 | 9,184.76 | 10,684.74 | 15.0% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
□ 북미 시장 분석 및 전망
○ 미국 시장
╶︎2022년 22억 4,725만 달러 규모로 북미 시장의 90.4%를 점유하며 시장을 주도
╶︎유전자 치료법 개발, 유전자 변형 작물(GMO) 사용 증가, 미국 내 연구 보조금·펀딩 가용성 증가
╶︎2023년 종양학·면역학에 대한 관심 증가로 제약 및 생명공학 기업 부문에 걸쳐 거래 규모가 2,250억 달러에 달하는 인수 합병이 예상되며 더 높은 성장을 전망
※︎존슨앤존슨은 아비오메드를 189억 달러에 인수, 화이자는 바이오헤이븐 파마슈티컬스를 122억 달러에 인수 계약을 체결
○ 캐나다 시장
╶︎2억 3,782만 달러 규모의 시장을 형성하며 정부 이니셔티브와 국가 내 유전체 R&D 강화로 향후 성장 예상
[표 13] 북미 유전자 편집 시장 규모, 2022~2028(MUSD)
국가/북미 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
미국 | 1,989.68 | 2,247.25 | 2,547.07 | 2,899.51 | 3,316.55 | 3,817.95 | 4,423.58 | 14.5% |
캐나다 | 211.29 | 237.82 | 268.62 | 304.72 | 347.34 | 398.45 | 460.04 | 14.1% |
총합 | 2,200.97 | 2,485.07 | 2,815.68 | 3,204.24 | 3,663.89 | 4,216.40 | 4,883.61 | 14.5% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
연간 성장률(2023~2028) 14.5% | 2023년 시장 규모 24억 8,507만 달러 | 가장 큰 시장 국가 미국 | 2022 세계 시장 점유율 46.9% | |||||||||
2023년 기술 기준 시장 규모(MUSD) | 2023년 최종 사용자 기준 시장 규모(MUSD) | |||||||||||
|
| |||||||||||
2023년 국가별 시장 규모(MUSD) | 북미 지역 성장 원동력 | |||||||||||
| ▪연구 보조금 및 펀딩 가용성 증가 ▪유전자 치료법(gene therapy) 개발 증가 ▪정부 이니셔티브와 유전체 R&D 증가 ▪유전자 변형(GM) 작물 사용 증가 | |||||||||||
[그림 9] 북미 유전자편집 시장 스냅샷
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
□ 유럽 시장 분석 및 전망
○ 가장 큰 시장을 형성하는 국가는 독일로, 2022년 2억 6,919만 달러 규모로 유럽 시장의 23.6%를 점유하며 시장을 주도
╶︎그 뒤로 영국(17.3%), 프랑스(14.3%), 이탈리아(8.7%), 스페인(5.7%), 기타(30%) 순으로 시장을 형성
╶︎정부의 자금 가용성, 제약 및 생명공학 기업의 성장, 유전자 엔지니어링 관련 유전자편집 환경을 지원하는 프로그램 시행 등으로 시장 성장을 전망
※︎2018년 영국, 노르웨이 포함 100만개 유전체 분석 이니셔티브 및 Horizon 2020 프로젝트로 유럽 유전체 및 임상 데이터 인프라를 구축
[표 14] 유럽 유전자 편집 시장 규모, 2022~2028(MUSD)
국가/유럽 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
독일 | 269.19 | 307.66 | 352.86 | 406.47 | 470.46 | 548.02 | 642.48 | 15.9% |
영국 | 197.98 | 226.97 | 261.11 | 301.69 | 350.22 | 409.16 | 481.09 | 16.2% |
프랑스 | 163.79 | 186.88 | 213.97 | 246.06 | 284.32 | 330.63 | 386.98 | 15.7% |
이탈리아 | 99.42 | 113.06 | 129.04 | 147.91 | 170.35 | 197.47 | 230.38 | 15.3% |
스페인 | 64.95 | 73.56 | 83.60 | 95.43 | 109.45 | 126.33 | 146.76 | 14.8% |
기타 | 344.11 | 389.20 | 441.73 | 503.52 | 576.67 | 664.67 | 771.03 | 14.7% |
총합 | 1,139.44 | 1,297.34 | 1,482.31 | 1,701.07 | 1,961.48 | 2,276.28 | 2,658.71 | 15.4% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
연간 성장률(2023~2028) 15.4% | 2023년 시장 규모 12억 9,734만 달러 | 가장 큰 시장 국가 독일 | 2022 세계 시장 점유율 24.3% | |||||||||
2023년 기술 기준 시장 규모(MUSD) | 2023년 최종 사용자 기준 시장 규모(MUSD) | |||||||||||
|
| |||||||||||
2023년 국가별 시장 규모(MUSD) | 북미 지역 성장 원동력 | |||||||||||
| ▪정부의 자금 가용성 ▪유전자편집 환경을 지원하는 프로그램 시행
| |||||||||||
[그림 10] 유럽 유전자편집 시장 스냅샷
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
□ 아시아·태평양 시장 분석 및 전망
○ 가장 큰 시장을 형성하는 국가는 중국으로, 2022년 3억 8,635만 달러 규모로 아시아·태평양 시장의 33.9%를 점유하며 시장을 주도
╶︎그 뒤로 일본(22.5%), 인도(14.5%), 한국(5.8%), 기타(20.8%) 순으로 시장을 형성
╶︎제약 및 생명공학 산업 분야의 정부 지원이 증가하는 추세로 R&D, 유전공학 기술 및 유전체 데이터 분석기술 개발에 주력하는 것이 특징
╶︎강력한 서비스 및 아웃소싱 부문을 보유하고 있어 유전자편집 시장의 전망에 유리하며 가장 빠르게 성장하는 지역
※︎중국, 한국, 호주, 싱가포르, 인도는 우호적인 정부 지원으로 유전체 연구 및 활용 기술에서 수익성이 높은 시장으로 향후, 유전자편집 시장의 전망에서 유리
※︎중국 BGI(Beijing Genomic Institute)는 세계 최대의 유전체 센터이자 시퀀싱 제공 업체 중 하나로 시퀀싱 비용 경제성으로 유전자가위 기술 도입에 대한 수요 증가
※︎일본 의료 연구 개발청의 재생의학 프로젝트 및 암 연구 프로젝트에서 유전자편집 기술의 높은 활용도로 지속적 성장이 기대
[표 15] 아시아·태평양 유전자 편집 시장 규모, 2022~2028(MUSD)
국가/유럽 | 2022 | 2023 | 2024 | 2025 | 2026 | 2027 | 2028 | CAGR (2023~ 2028) |
중국 | 386.35 | 442.00 | 507.43 | 585.43 | 677.82 | 790.29 | 927.36 | 16.0% |
일본 | 256.83 | 293.70 | 337.03 | 388.44 | 449.82 | 524.24 | 614.91 | 15.9% |
인도 | 164.82 | 189.60 | 218.85 | 253.70 | 295.47 | 346.31 | 408.50 | 16.6% |
한국 | 65.7 | 74.30 | 84.40 | 96.20 | 110.1 | 126.90 | 147.2 | 15.0% |
기타 | 238.10 | 269.06 | 305.00 | 347.29 | 397.35 | 457.40 | 529.86 | 14.5% |
총합 | 1,111.80 | 1,268.66 | 1,452.71 | 1,670.70 | 1,930.57 | 2,245.15 | 2,627.84 | 15.7% |
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
연간 성장률(2023~2028) 15.7% | 2023년 시장 규모 12억 6,866만 달러 | 가장 큰 시장 국가 중국 | 2022 세계 시장 점유율 23.7% | |||||||||||||||
2023년 기술 기준 시장 규모(MUSD) | 2023년 최종 사용자 기준 시장 규모(MUSD) | |||||||||||||||||
|
| |||||||||||||||||
2023년 기술 기준 시장 규모(MUSD) | 2023년 최종 사용자 기준 시장 규모(MUSD) | |||||||||||||||||
|
| |||||||||||||||||
2023년 국가별 시장 규모(MUSD) | 아시아·태평양 지역 성장 원동력 | |||||||||||||||||
| ▪제약 및 생명공학 분야의 정부 지원 증가 ▪제약 R&D, 임상 실험 증가 ▪글로벌 제약사에 의한 투자 증가 ▪저렴한 운영비용(Low operating cost)
| |||||||||||||||||
[그림 11] 아시아·태평양 유전자편집 시장 스냅샷
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6, 국가생명공학정책연구센터 재가공
3. 주요 기업 동향
1) 시장 점유율 분석(2022)
□ 2022년 상위 4개 기업이 약 18~20%의 시장 점유율을 차지하고 나머지 기업이 약 80%를 차지하는 매우 세분화된 시장
○ (써모피셔 사이언티픽) 전체시장의 13~14%를 점유하며 CRISPR-Cas9 및 탈렌 기반 유전자 편집 및 분석을 위한 다양한 포트폴리오를 구축
╶︎고효율 유전자 발현·전달 시스템을 제공하여 안정적인 유전자 변형 세포주 개발에 기여
╶︎CRISPR-Cas9 및 탈렌 기반 진단, 백신, 유전자 변형 동물을 포함한 계약 제조 서비스 제공
○ (머크) 전체시장의 1~2%를 점유하며, 유전체 맞춤의학 분야 제약사에 독점 유전자편집 기술 라이센스를 부여하며 시장에서 입지를 강화
╶︎CRISPR-Cas9 기본 기술을 포함하여 28개의 CRISPR 관련 특허 보유
╶︎식물육종 기업, BettersSeeds와 협력·라이센스 계약 체결(2022.3)
○ (진스크립트(GenScript)) 전체 시장의 1%를 점유하며 유전자편집을 위한 포괄적인 제품 및 서비스를 제공
╶︎브로드 연구소의 펭장(Feng Zhang) 연구실과 파트너십을 통해 검증된 CRISPR 제품 및 서비스를 제공
○ 그 뒤로 애질런트 테크놀로지스가 약 0.5~1%의 시장 점유율을 차지
※︎그 외 퍼킨엘머, 론자, 테칸, 상가모 테라퓨틱스, 에디타스 메디슨, 크리스퍼 테라퓨틱스, 프리시전 바이오사이언스, 셀렉티스, 맘모스 바이오사이언스, 신테고, 블루버드 바이오 등 나머지 기업이 전체 시장의 약 80%를 세분

[그림 12] 주요 기업 시장 점유율(2022)
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
2) 4분면(Quadrant) 분석을 활용한 상위 15개 기업 평가(2022)
□ 비즈니스 전략(Product footprint)과 시장 점유율을 기준으로 분류
○ STARS: 확고한 제품 포트폴리오, 광범위한 응용범위, 강력한 지리적 입지 확보 및 혁신적인 제품·서비스를 제공하여 높은 시장 점유율을 차지
╶︎써모피셔 사이언티픽, 머크, 퍼킨엘머, 진스크립트, 론자
○ Emerging Leaders: 경쟁사 대비 상당한 제품 혁신과 시장 입지를 확보하여 높은 시장 점유율을 차지했으나 강력한 성장 전략이 없음
╶︎프리시전 바이오사이언스, 셀렉티스
○ Participants: 틈새 제품을 제공, 강력한 비즈니스 전략이 없음
╶︎에디타스 메디슨, 크리스퍼 테라퓨틱스, 인텔리아 테라퓨틱스, 신테고, 리제네론
○ Pervasive Players: 매우 강한 비즈니스 전략을 갖추었으나 제품 포트폴리오가 약하고 시장 점유율이 낮음
╶︎애질런트 테크놀로지스, 블루버드 바이오, 상가모, 테칸 라이프사이언스, 퍼킨엘머, 진스크립트, 론자

[그림 13] 4분면 분석을 활용한 상위 15개 기업 평가(2022)
출처: Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6
3) 주요 기업 유전자편집 치료제 임상 현황
□ 유전자편집 기술로 촉진되는 희귀 유전질환 치료제 개발
○ 최근, 미충족 수요가 높은 희귀 유전질환과 다양한 적응증에 대한 치료제 개발에 크리스퍼 기술의 활용이 촉진
╶︎영국 의약품 규제청은 버텍스 제약사와 크리스퍼 테라퓨틱스가 공동 개발한 CRISPR-Cas9 적용 Ex-vivo 혈액질환 치료제, ‘카스게비(미국 상품명: 엑사셀)’의 판매를 세계 최초로 승인(‘23.11.16)하면서 사상 첫 크리스퍼 치료제가 탄생
╶︎그 외 다양한 적응증에 CRISPR 기술 적용 치료제가 빠르게 임상에 진입하면서 향후 신약 출시로 빠른 시장 성장을 전망
○ 유전자가위 기술이 핵심으로, 연구소를 기반으로 창업(Spin out)한 기업이 유전자편집 치료제 개발 시장을 선도
※︎주요 센트럴 랩은 UC 버클리대, 브로드 연구소이며 이들 2곳 기관에서 11개 기업이 창업
|
| CRISPR-Cas |
|
|
| CRISPR-Cas3 | |||||
|
|
|
|
|
|
| |||||
UC버클리 대학 비엔나 대학 |
| 브로드 연구소 MIT·하버드 대학 |
|
|
| 노스캐롤라이나 주립 대학 | |||||
↓ |
| ↓ |
|
|
|
| |||||
제니퍼 다우드나 엠마뉘엘 샤르팡티에 |
| 펭장 (Feng Zhang) |
| 엠마뉘엘 샤르팡티에 |
| ↓ | |||||
↓ |
| ↓ |
| ↓ |
|
| |||||
기업분할(spin out) |
| 기업분할(spin out) |
| 기업분할(spin out) |
| 기업분할(spin out) | |||||
↓ |
| ↓ |
| ↓ |
| ↓ | |||||
| 에디타스 메디슨 (Editas Medicines) |
|
| ||||||||
| ↓ |
|
| ||||||||
카리브(Caribou) 바이오사이언스 |
| 프라임 메디슨 (Prime Medicine) |
| 크리스퍼 테라퓨틱스 (Editas Medicines) |
| 로커스 바이오사이언스 (Locus Biosciences) | |||||
↓ |
| ↓ |
| ↓ |
|
| |||||
인텔라 테라퓨틱스 (Intella Therapeutics) |
| 빔 테라퓨틱스 (Beam Therapeutics) |
| ERS 지노믹스 (ERS Genomics) |
|
| |||||
↓ |
| ↓ |
| ↓ |
| ||||||
맘모스(Mammoth) 바이오사이언스 |
| 셜록 바이오사이언스 (Sherlock Bioscience) |
| 카세비아 테라퓨틱스 (Casebia Therapeutics) |
| ||||||
|
| ↓ |
|
|
| ||||||
|
| 아버(Arbor) 바이오테크놀로지 |
|
|
|
[그림 14] 유전자편집기술 센트럴랩
출처 : Advances in Gene Editing Technologies in Healthcare, 2023. 국가생명공학정책연구센터 재가공
□ 크리스퍼 기술 기반 유전자편집 치료제 동향
○ 최초의 크리스퍼 치료제, 카스게비 외 다양한 크리스퍼 기술 기반 유전자편집 치료제가 임상 단계 진입
╶︎체외 유전자편집 치료제가 체내 치료제에 비해 개발 단계가 앞서 있고 체내 유전자편집 치료제는 종류가 많지 않고 대부분 임상 1/2상 단계
╶︎(CRISPR-Cas9 치료제) 크리스퍼 테라퓨틱스, 인텔리아 테라퓨틱스, 에디타스 메디슨이 3대 주요 기업으로 꼽히며 글로벌 시장을 선도
╶︎(염기편집 치료제) 해당 기술 개발자인 브로드 연구소 펭장(Feng Zhang) 박사의 빔 테라퓨틱스가 선두 기업
╶︎(프라임편집 치료제) 해당 기술 개발자인 브로드 연구소의 데이비드 리우 박사가 설립한 프라임 메디슨이 선두기업이며 18개 전임상 파이프라인을 구축
[표 16] 크리스퍼 기술 기반 유전자편집 치료제 개발 현황
주요 기업 | 대표 기술 | 치료제(파이프라인) | 개요 |
크리스퍼 테라퓨틱스 | CRISPR-Cas9 ex-vivo 치료제 | <Ex-vivo 치료제> • CTX-001(엑사셀, SCD/TDT) - 영국 의약품 규제청 승인(‘23.11.16) • CTX-110(항암, CAR-T) • CTX-120(항암, CAR-T) • CTX-130(항암, CAR-T) <In-vivo 치료제> - 낭성섬유증, 뒤센근이영양증, 글리코겐 축적증, 근디스트로피 질환 치료제 연구개발 중 | - 샤르팡티에 설립(2013)
|
인텔리아 테라퓨틱스 | LNP 기반 In-vivo CRISPR-Cas9 치료제 | <Ex-vivo 치료제> • LTLA-5001(백혈병, TAR-T) • QTQ-923(SCD) • HIX-763(SCD) <In-vivo 치료제> • NTLA-2001(심근병증,hATTR) • NTLA-2002(혈관부종,HAE) | - 제니퍼 다우드나설립(2014)
|
에디타스 메디슨 | 변형 캐스9, SaCas9, Cas12a 치료제 | • EDIT-301(SCD/TDT) • CAR-T(항암, 전임상) • EDIT-101(레베르 흑암시) • EDIT-102(망막질환) | - 제니퍼 다우드나설립(2013)
|
익시전 바이오 테라퓨틱스 | 이중 gRNA In-vivo 크리스퍼 캐스9 항바이러스 치료제 | <In-vivo 치료제> • EBT-101(HIV)
| - 카멜 칼릴리 설립(2015)
|
툴젠 | 초소형 CRISPR- Cas9, CjCas9치료제 | <Ex-vivo 치료제> • CTH-004(고형암, CAR-T) <In-vivo 치료제> • TGT-001(CMT1A) | - 김진수 박사 설립(1999)
|
빔 테라퓨틱스 | In-vivo 염기편집 치료제 | <In-vivo 치료제> • BEAM-101(SCD/TDT) | - 펭장, 데이비드 리우 설립(2019) |
버브 테라퓨틱스 | In-vivo 염기편집 치료제 | <In-vivo 치료제> • VERVE-101(심혈관) | - 세카르 카티레산 설립(2019) |
프라임 메디슨 | 프라임편집 치료제 | • 18개 전임상 파이프라인(간질환, 난청, 신경근육질환, 뒤센형근이영양증 등) 구축 | - 데이비드 리우 설립(2019) |
출처: 프로스트앤드설리번, Growth Opportunities in Gene Editing Technologies, Advanced Biomanufacturing, Drug Discovery and Precision Medicine, 2022.11/ 국가생명공학정책연구센터 재구성
4. 성장 전략
1) 성장동인, 억제 및 기회 요인
성장(Drivers) | 1~2년 | 3~4년 | 5~6년 |
ㅇ 현장진단 수요증가 ※ CRISPR-Cas는 저비용, 신속 정확한 휴대 가능한 핵산 기반 진단을 제공 ※ 향후, 감염병 진단의 표준, 핵산기반 진단법은 CRISPR-Cas 기반 기술로 보편화될 것 ※ PCR 진단법은 소량의 DNA 또는 RNA를 명확히 검출하나 기술의 복잡성으로 실험실 내 검사로 제한되는 한계점
| 높음 | 높음 | 높음 |
ㅇ 정부·민간 투자 증가 및 연구 프로젝트 수 증가 ※ 2022.3 미국 NIH는 유전자편집 연구 프로젝트에 8,900만 달러 예산 지원 ※ 정부와 VC 자금은 R&D 및 임상시험을 지원하여 많은 치료 후보물질이 1·2상 임상 단계에 진입 | 높음 | 높음 | 높음 |
ㅇ 기업간 협력 증가 ※ 스타트업과 대형 제약사, 기술 개발자(연구실)와 기업간의 R&D, 제품개발, 임상 협력은 기술과 산업 성장을 주도 | 낮음 | 높음 | 중간 |
ㅇ 응용 범위 확대 ※ 유전질환 치료를 넘어 신약발굴, 감염병 제어, 기후변화, 바이오 연료,동·식물 품종개량, 이종장기, 멸종동물 복원 등 응용 분야 확대로 시장 범위 확대 | 높음 | 높음 | 높음 |
ㅇ CRISPR-Cas9 도입 ※ 저비용, 가장 간편한 설계·제조·조작으로 높은 효율성과 광범위한 적용 가능성은 유전자 편집의 혁신과 민주화에 기여 | 높음 | 높음 | 중간 |
억제(Restraints) | 1~2년 | 3~4년 | 5~6년 |
ㅇ 높은 치료비용 ※ 단일 유전자편집 치료비용은 약 200만 달러로 추정되어 저소득층, 중간 소득층의 접근이 제한 | 높음 | 높음 | 중간 |
ㅇ CRISPR-Cas9의 비표적 유전자 편집 가능성 ※ CRISPR-Cas9은 특정 유전자를 표적으로 삼는데 높은 정밀도를 제공하지만 표적 외 다른 부위에서 의도치 않은 변형 가능성이 존재 | 높음 | 중간 | 낮음 |
기회(Opportunities) | 1~2년 | 3~4년 | 5~6년 |
ㅇ 맞춤형 치료 분야에서 유전자편집 기술의 광범위한 활용 ※ 유전자편집 기술을 활용하여 개인의 고유한 유전적 프로필에 맞게 최적화된 다양한 질환에 대한 유전자편집 치료법 제공 | 높음 | 높음 | 중간 |
ㅇ 유전자 치료의 파이프라인 확장 ※ 외래 정상 유전자나 핵산을 주입하는 유전자 치료법에서 유전적 결함을 직접 교정하여 정상 유전자로 복원하는 치료제로 파이프라인 확장 | 중간 | 중간 | 낮음 |
출처 : Advances in Gene Editing Technologies in Healthcare, 2023. Markets and Markets, Gene editing market-Global forecast to 2028, 2023.6국가생명공학정책연구센터 재가공
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 유전자편집 기술의 글로벌 시장 현황 및 전망_No187.pdf
유전자편집 기술의 글로벌 시장 현황 및 전망_No187.pdf
 글로벌 유전자편집 시장 전망
글로벌 유전자편집 시장 전망
 1~3세대 및 차세대 유전자가위
1~3세대 및 차세대 유전자가위