부처보도자료
‘모더나 코비드-19백신주’ 품목허가
- 등록일2021-05-24
- 조회수2159
-
발간일
2021-05-21
-
출처
식품의약품안전처
- 원문링크
-
키워드
#모더나 코비드 백신주#코로나 백신
- 첨부파일
‘모더나 코비드-19백신주’ 품목허가
□ 식품의약품안전처(처장 김강립)는 오늘 외부 전문가가 포함된 최종점검위원회를열고 녹십자社가 2021년 4월 12일(월)에 수입품목 허가를 신청한 코로나19 백신 ‘모더나 코비드-19백신주’에 대해 임상시험 최종결과보고서등을 제출하는 조건으로 수입품목허가를결정했습니다.
1. 제품개요
□ 녹십자社가 수입품목허가 신청한 ‘모더나 코비드-19백신주’는 미국 모더나社가 개발한 mRNA 백신으로, 코로나19 바이러스 항원 유전자를 mRNA 형태로 주입하여 체내에서 항원 단백질을 합성하고, 이 단백질이 중화항체의 생성을 유도함으로써 코로나19 바이러스가 인체에침입했을 때 바이러스를 중화해 제거하게 됩니다.
* RNA(Ribonucleic acid) : 유전자 정보를 매개, 유전자 발현 조절 등의 역할을 하는 세포의 핵 속에 있는 두 종류의 핵산 중 하나
○ 이 약의 효능‧효과는 18세 이상에서 코로나19의 예방이며 용법‧용량은 해동 후 0.5 mL을 1회 접종 후 4주 후에 추가 접종하고 보관조건은 냉동(영하 25~15℃)에서 7개월, 냉장(2~8℃) 1개월입니다.
* 개봉전 상온(8~25℃) 12시간 보관 가능
□ ‘모더나 코비드-19백신주’는 국내에서 네 번째, mRNA 백신으로는 국내에서 두번째로 허가받는백신이며 유럽(EMA), 미국 등 39개* 국가와WHO에서 조건부 허가 또는 긴급사용승인을 받았습니다.
* (조건부허가)유럽(EMA) 27개국, 캐나다, 스위스
(긴급사용승인)미국, 영국, 이스라엘, 카타르, 싱가포르, 파라과이, 브루나이,타이완, 필리핀, 태국, 세계보건기구(WHO)
2. 허가심사 진행경과
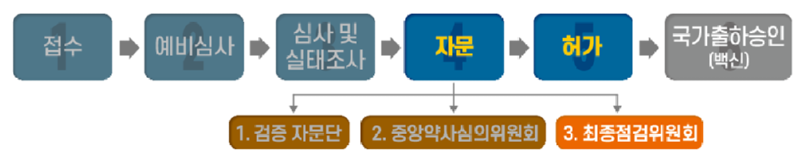
□ 식약처는 안전을최우선으로 과학적 근거에 기반을 두고 철저한 심사를 진행해 왔습니다.
○ 식약처 내 분야별 전문심사인력으로 구성된 ‘코로나19 치료제‧백신심사팀’이 비임상·임상·품질 등 허가에필요한자료를집중 심사했습니다.
- 비임상시험심사는 동물에서 백신의 효과를 보는 효력시험(바이러스 중화역가, 면역반응, 증상 등), 약물의 흡수·분포·대사·배설에 관한약동학시험, 약물로 인한 독성을 확인하는 독성시험(반복투여독성, 생식발생독성 등)에 대해 평가했습니다.
- 임상시험 심사는미국(1상‧2a상‧3상)에서 수행된 임상시험 총 3건의자료가 제출되었으며, 미국에서 수행된 3상 임상시험에서 안전성과효과성을평가했습니다.
- 품질 심사는 제조방법, 기준 및 시험방법등 자료 심사와 함께 제품의 품질이 일관되게생산할 수 있는 시설과 관리체계등을 갖추었는지에 관한 해외제조소의 제조·품질관리기준(GMP) 실시상황에 대해 서류 평가를 실시했습니다.
* 의약품 제조 및 품질관리기준(Good Manufacturing Practice, GMP) : 품질이보증된 우수한 의약품을 제조하기 위하여 시설장비 및 생산공정 전반에 걸쳐 의약품 제조업자가 준수해야 할 기준
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 5.21+바이오의약품정책과+등.hwp
5.21+바이오의약품정책과+등.hwp