1형 인터페론은 세포내의 항균성 기작들을 활성화하고 선천성 (innate), 후천성 면역반응 (adaptive immune response)의 발달에 영향을 준다. 표준 1형 인터페론 시그널링은 Janus Kinase (JAK) ? 신호 변환기 및 전사 활성제 (signal transducer and activator of tranion, STAT) 경로를 활성화하여, 인터페론 유도형 유전자 (IFN-stimulated genes, ISGs)의 전사 (tranion)를 유도한다. 숙주 (host), 병원체 (pathogen) 그리고 환경인자 (environmental factor)들은 이 신호경로 (signaling pathway)를 통해 세포의 반응을 조절하고 조직손상을 제한하고 자가면역 (autoimmunity)를 막는 동안 숙주의 방어체계를 조정한다. 이 논문에서, 우리는 1형 인터페론에 유도되는 STAT 활성화와 인터페론 유도형 유전자의 전사 및 번역 (translation) 을 조절하는 신호전달과 후생적 기작 (epigenetic mechanism) 에 대해서 요약하였다. 이러한 조절 기작들은 1형 인터페론 반응의 생물학적 결과와 병원체가 효과적으로 제거되는지 아니면 만성 감염이 되는지 혹은 자기면역질환이 뒤따르는지에 대해 결정한다.
목차
1. 서론
2. 1형 인터페론 신호전달의 조절
2.1 기본적 1형 인터페론 신호전달
2.2 1형 인터페론 신호전달의 증가
2.3 1형 인터페론 신호전달의 억제
2.4 1형 인터페론 신호전달의 정성적 조절
3. 1형 인터페론에 의해 유도되는 전사의 조절
3.1 번역 후 변형 (Post-translational modification)
3.2 다른 전사 인자들과의 협동
3.3 염색질 리모델링
3.4 전사 신장
3.5 후생유전학적 상황
4. 1형 인터페론 반응의 번역 조절
5. 만성 인터페론 반응의 조절
5.1 자가면역질환에서의 1형 인터페론의 기능
5.2 TNF와 인터페론 신호전달경로 사이의 교차조절
5.3 1형 인터페론에 의해 매개되는 면역억제
6. 맺음말
1. 서론
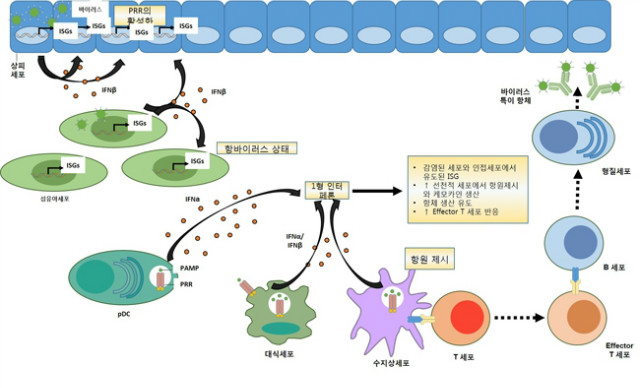
1형 인터페론 (Type I interferons, IFNs) 은 감염된 세포로부터 분비되는 폴리펩티드이며 3가지의 중요한 기능을 가진다. 첫째로, 1형 인터페론은 감염된 세포나 그 주변의 세포들에서 특히 바이러스 같은 감염성 물질의 확산을 제한하는 세포 안에 내재된 항균성 상태를 유도한다. 둘째로, 1형 인터페론은 염증 전 반응 (pro-inflammatory response)와 싸이토카인 생산을 억제하는 반면 항원 제시 (antigen presentation) 나 natural killer cell (NK세포)의 기능을 촉진하는 균형 잡힌 상태로 선천성 면역반응을 조절한다. 셋째로, 1형 인터페론은 후천성 면역반응을 활성화시켜 높은 친화성을 가지는 항원 특이적인 T 세포와 B 세포 반응과 면역 기억 (immunological memory)를 촉진한다 (그림 1). 1형 인터페론은 급성 바이러스 감염에는 방어적 기작을 하지만 박테리아 감염이나 자가면역질환에 대해서는 방어적 기작과 유해한 기작을 같이 하게 된다.
이 논문에서는 가장 많이 그리고 잘 알려진 IFN-alpha (IFNα) 와 IFN-beta (IFNβ) 에 대해서 집중적으로 설명하려고 한다. 아주 많은 유형의 세포들이 IFNβ를 생산하는 반면에 특히 형질세포 모양 수지상 세포 (plasmacytoid dendritic cells) 와 같은 조혈세포 (haematopoietic cell)은 IFNα의 주된 생산 세포이다. IFNβ는 단독의 IFNB 유전자로부터 표현되지만 IFNα는 14개의 별개의 유전자가 다양한 IFNα동형을 만들어낸다. 1형 인터페론 생산은 미생물의 부산물이 패턴 인식 수용체 (pattern-recognition receptor, PRRs)과 싸이토카인에 의해서 감지된 후에 유도된다. BOX 1에 1형 인터페론 생산에 관련된 최근에 연구된 내용들이 정리되어 있다.
Box1. 1형 인터페론 생산에 대한 새로운 관점
|
미생물 부산물들이 다양한 세포 수용체에 의해 감지되었을 때, 인터페론 유도형 유전자 발현을 유도하는 1형 인터페론 매개의 자가분비 루프를 야기하는 IFNα나 IFNβ들이 유도된다. 이러한 과정은 여러 가지 논문들에서 많이 보고되어있다. 그러나 최근에 몇 가지 보고들은 어떻게 1형 인터페론의 생산이 조절되는지에 대해서 더 다양한 정보를 보여준다. 중요한 새로운 관점은 다음과 같다.
? 생리학적 조건에서 1형 인터페론 생산의 기저수준은 공생균 미생물총에 의해서 유지된다.
? 1형 인터페론은 인터페론 조절인자 (IFN-regulatory factor, IRF) 3과 IRF7보다는 IRF1의 신호를 전달하는 기주의 인자들과 종양괴사인자 (tumour necrosis factor, TNF)와 같은 싸이토카인에 의해 유도되고, 대식세포증식자극인자 (macrophage colony stimulating factor, M-CSF)와receptor activator of NF-κB ligand (RANKL)에 의해서도 유도될 수 있다.
? IFNε는 여성의 생식기관 상피에서 항상 일정 수준으로 발현되고 이 발현은 성 호르몬에 의해서 조절된다.
? 글리코겐 합성 인산화효소 (glycogen synthase kinase 3, GSK3)은 IFNβ 생산을 음성적으로 조절한다.
? 히스톤탈아세틸화효소 (histone deacetylase 3, HDAC3)은 Ifnb 발현에 매우 중요하다. 이것은 염색질 리모델링과 1형 인터페론 생산에 있어서 후생적 기작을 위한 역할을 지원한다.
? 자가면역과 관련이 있는 Tyrosine-protein phosphatase non-receptor type 22 (PTPN22)는 TNF re-ceptor-associated factor 3 (TRAF3)와 연합하여 Toll 유사 수용체 (Toll-like receptor)에 의해 유도되는 1형 인터페론 생산을 증가시킨다.
? 번역 후 기작 (post-translational mechanism)들은 1형 인터페론 생산을 조절한다. Ifna와 Ifnb 전사체는 안정성 혹은 불안전성을 RNA 결합 요소들과의 연합에 따라서 부여하는 다양한 RNA 조절요소를 가지고 있다. 전사체는 3’ 비해석 부위 (untranslated region, UTR) 부분에 AU-rich elements (AREs)를 포함할 뿐 아니라 5’ 비해석 부위와 암호영역에 여러 가지 모티프를 포함한다. 최근 보고에 따르면 특정 바이러스들에 감염이 일어나는 동안 Ifnb의 mRNA 전사체의 안정성은 Ifnb 전사체의 비아데닐화 (de-adenylation)을 막아주는 protein kinase RNA-activated (PKR) 활성에 따라서 결정된다. 20여개의 다양한 유전자들의 1형 인터페론 단백질을 코딩하기 때문에 이것은 굉장히 엄격한 조절을 위한 풍성한 리소스를 제공한다. 특히 병원체의 감염이 일어나는 동안 IFN 전사체들의 효율적인 번역을 확실하게 하는 기능에 관해서 정보를 제공한다.?? |
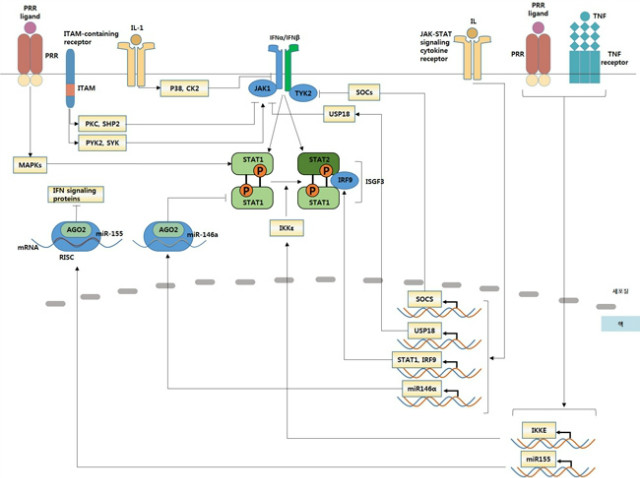
IFNα와 IFNβ는 헤테로다이머로서 IFNAR1과 IFNAR2 서브유닛으로 이루어진 막관통 수용체인 IFNα 수용체 (IFNAR)와 결합한다. 25여년전 보고된 기존의 1형 인터페론에 의해 유도되는 신호전달체계에서는 IFNAR은 잠재적인 세포질의 전사인자인 신호 변환기 및 전사 활성제 (signal transducer and activator of tranion, STAT) 1과 STAT2를 인산화시키는 tyrosine kinase Janus kinase 1 (JAK1)과 tyrosine kinase 2 (TYK2)를 활성화시킨다 (그림 2). Tyrosine에 의해 인산화된 STAT1과 STAT2는 다이머를 형성하고 핵 안으로 이동하여 IFN 조절인자 9 (IRF9)와 결합하여 IFN-stimulated gene factor 3 (ISFG3)이라고 불리는 3분자의 (trimolecular) 복합체를 형성한다. ISFG3은 인터페론자극반응요소 (IFN-stimulated response elements, ISREs; consensus sequence TTTCNNTTTC) 로 알려져 있는 그 본래의 DNA 서열에 결합을 하고 ISGs 의 전사를 활성화시킨다. 반대로, 다른 수많은 싸이토카인들은 다른 gamma-activated sequence (GAS; consensus sequence TTCNNNGAA)에 결합하는 STAT 호모다이머를 활성화시킨다. 그래서 기존의 1형 인터페론 신호전달은 다양한 세포적 항바이러스 상태를 만들어내는 각기 다른 수백 가지의 ISRE-driven ISGs들을 유도한다. ISG에 의해 코딩된 단백질들은 바이러스의 전사, 번역, 복제의 억제, 바이러스의 핵산의 분해, 세포의 지방 대사의 변화와 같은 다양한 여러 가지 기작들에 의해서 병원체를 억제한다.
그림 1. 1형 인터페론의 선천성, 후천성 면역과 세포 내 항균성 프로그램 조절
IFNAR ligation 에 대한 세포반응은 세포 유형과 상황에 따라 다르고 면역반응의 과정에 따라 다르다. 이러한 차이는 IFNAR에 의해 유도된 신호들을 어떻게 세포들이 해석하는지에 대해서 바꾸는 세포의 혈통과 발달의 차이들에 의해 나타나고 패턴인식수용체와 환경적 인자들, 병원체들에 의해서 유도되는 동시다발적 신호들에 의한 IFNAR 신호전달과 ISG 발현의 조절에 의해서 나타난다. 이러한 이상발생의 신호들은 몇 가지 수준에서 IFNAR ligation에 대한 세포 반응들을 조절한다. 첫 번째로 IFNAR과 JAK-STAT 신호전달 구성성분들의 발현과 번역 후 변형 (post-translational modification)을 조절해서 IFNAR 신호전달의 규모와 패턴을 조절한다. 둘째로, STATs과 작용하는 전사인자들을 촉진하고 타깃 유전자 좌위의 염색질 상태를 조절함으로써 아래 단계에 있는 ISG 발현을 특정화한다. 조절한다. 셋째로, 번역을 매개하는 인자들을 변형하여 단백질 발현의 패턴을 조절한다. 1형 인터페론 반응은 기주 인자들에 의해 유도되는 반대로 증가되거나 억제시키는 신호들에 의해 잘 조절된다; 이러한 신호들은 빠르게 부수적으로 생기는 독성을 피하기 위해서 반응을 억제하는 동안 침입하는 병원체들에 대해서 효율적인 항미생물 반응을 이끌어낸다. 병원체들은 1형 인터페론들의 항미생물 반응을 피하기 위해서 몇 가지의 같은 억제 기작들을 이용한다. 이 리뷰 논문에서는 어떻게 기주와 병원체 그리고 환경적인 인자들이 IFNAR에 의해 유도되는 신호체계와 1형 인터페론 신호전달의 생물학적 결과를 결정하기 위해 전사, 번역을 상호 조절하는지에 대해서 포커스를 두고 있다.
그림 2. 1형 인터페론 신호전달경로
2. 1형 인터페론 신호전달의 조절
2.1 1형 인터페론 신호전달의 조절
1형 인터페론 신호전달체계의 구성요소인 IFNAR, JAK1, TYK2, STAT1, STAT2, IRF9는 드넓게 발현되고 있고 그래서 다양한 세포 유형들이 1형 인터페론의 의존적인 반응들을 증가시키기에 적합하다. 변역 세포들은 낮은 레벨의 1형 인터페론에 대해서 빠르게 반응할 수 있으며, 이는 적은 양의 IFNβ가 STAT1과 IRF9의 높은 기저발현수준을 유지하는 자가분비 루프에 의해 항상성 조건에서 유지된다. 기저 수준의 IFN? 발현과 tonic IFNAR 신호전달은 면역세포들이 효과적인 항균 프로그램을 빠르게 가동할 수 있도록 만든다. 게다가 IFNAR 신호전달은 지속적으로 발현되는 내재적인 리간드와 결합하는 immunorecep- tor tyrosine-based activation motif (ITAM)와 연관된 면역 수용체에 의해서도 증가된다. Tonic ITAM 신호전달은 1형 인터페론에 의해 유도되는 JAK 활성화를 증폭하기 위해 protein tyrosine kinase 2 (PYK2)를 활성화시킨다. 동시에 기본적 IFNAR 신호전달의 규모는 IFNAR-JAK-STAT 신호전달 요소들의 발현을 제한하는 반대 기작에 의해서 억제된다. 이런 면역반응 중에 새롭게 생산된 1형 인터페론에 대한 세포 반응은 1형 인터페론에 의해 활성화 되는 피드백 기작과 기주의 싸이토카인과 미생물 인자로부터 발생되는 여러 가지 신호에 의해서 변형된다.
2.2 1형 인터페론 신호전달의 증가
1형 인터페론 신호전달을 증폭하는 기작들은 STAT1과 IRF9의 발현의 유도, spleen tyrosine kinase (SYK)와 PYK2에 의한 STAT tyrosine 인산화의 증가, serine 인산화에 의한 STAT1의 전사 활성의 증가를 포함한다. STAT1 레벨의 증가는 IFNAR에 의한 활성화와 상호관계를 일으키고 반면에 증가된 IRF9의 레벨은 ISFG3이 타깃 유전자에 결합하는 것을 촉진한다. 게다가 STAT 발현이 증가하면 낮은 농도의 IFN?와 함께 대식세포의 프라이밍은 SYK kinase와 IFNAR를 기능적으로 짝지어 신호전달과 STAT1 활성화를 증가시킨다. STAT1의 보존된 carboxy-terminal serine의 인산화는 다양한 protein kanse C (PKC)와 mitogen-activated protein kinase (MAPK)군에 의해 매개된다. 그래서 STAT1의 전사 활성과 아래 단계의 ISG 유도는 PKC와 MAPKs를 활성화시키는 많은 수의 기주 인자들 (염증성 싸이토카인들, 케모카인들)에 의해서 조절된다. 전반적으로 이러한 신호의 증폭은 감염 중 기주에 의한 1형 인터페론 반응을 향상시키고 1형 인터페론의 항균기능 및 항염증 기능을 촉진한다.
2.3 1형 인터페론 신호전달의 억제
1형 인터페론에 의한 반응을 억제하는 기작들은 다음과 같다.
1) 세포 표면의 IFNAR 발현의 억제조절.
: IFNAR의 내면화 (internalization)은 세포의 인터페론 반응성을 제한하기 위해 다양한 이상발생의 경로를 통해 유도된다. 이러한 경로는 IL-1과 같은 항염증 싸이토카인, TLRs, ITAM-associated 수용체, 산화적 혹은 대사적 스트레스에 의해 활성화된다. 억제 기작 중 하나는 p38 인산화 효소에 의해 매개되는 IFNAR의 세포질 도메인의 인산화에 대한 프라이밍으로 수용체의 내면화, 유비퀴틴화 (uniquitylation), 분해가 증가하는 것이다. 바이러스와 종양세포들도 1형 인터페론에 의한 항바이러스 및 항종양 효과를 피하기 위해 IFNAR 분해를 유도한다.
2) 싸이토카인 신호전달의 억제인자 (suppressor of cytokine signaling, SOC), ubiquitin car-boxy-terminal hydrolase 18 (USP18) 과 같은 음성적 조절인자
: 1형 인터페론은 반응의 범위와 지속되는 시간을 제한하기 위한 하나의 음성 피드백 루프의 부분으로 SOCS1, SOCS3, USP18을 유도한다. SOCS 단백질들은 IFNAR에 결합하기 위해 STAT과 경쟁하고 JAK 활성을 억제하는 반면에 USP18은 IFNAR2에서 JAK1을 분리한다. 이러한 억제단백질들은 JAK-STAT 신호전달을 활성화시키는 다양한 싸이토카인, ITAM-associated 수용체 (detin1을 포함하는), MAPK 경로를 활성화시키는 항염증성 싸이토카인과 PRR에 의해서 유도된다. 그래서 병원체들은 이 음성 조절자들을 이용하여 1형 인터페론에 의해 매개되는 항균작용들로부터 벗어날 수 있다.
3) miRNA의 유도 (그림 3)
: CD8+ T 세포에서 miR-155는 IFNAR-JAK-STAT 경로의 발현을 넓게 억제한다. 이러한 억제는 T 세포 증식에 대한 1형 인터페론의 음성 효과를 억제조절함으로써 바이러스와 박테리아 병원체들에 대한 CD8+ T 세포 반응을 향상시킨다.
그림 3. 상이한 경로를 통해 조절되는 1형 인터페론 신호전달
2.4 1형 인터페론 신호전달의 정성적 조절
IFNAR 신호전달의 규모뿐만 아니라 정성적인 상태 역시 조절되며, 따라서 일반적으로 가까운 신호에 대한 생물학적 결과는 구별될 수 있다. 어떻게 IFNAR 신호전달이 다른 여러 가지의 아래 단계의 유전자 발현의 패턴을 활성화 시킬 수 있는지에 대한 한가지 기작은 타깃 유전자와 생물학적 기능을 구별하는 STAT의 특이한 활성화이다. IFNAR은 대부분의 세포 유형에서 STAT1과 STAT3 호모다이머 그리고 헤테로다이머를 활성화시킬 수 있고 일부 세포 유형에서는 STAT4, STAT5, STAT6을 활성화시킬 수 있다. IFNAR에 의한 서로 다른 STAT의 활성화 간의 밸런스는 부분적으로 상대적 STAT 발현 레벨에 따라 결정된다. 그래서, 인터페론과 싸이토카인에 의한 STAT1 발현에 우선적인 유도는 1형 인터페론에 의해 유도된 STAT1 호모다이머의 활성화 및 GAS를 포함하는 항염증 유전자의 발현 증가와 관련이 있다. STAT1과는 대조적으로 STAT3는 염증반응을 억제하는 유전자를 활성화시키며, 1형 인터페론이 1형 인터페론에 의한 항염증성 경로를 억제하고 균형을 맞추는 STAT3에 의해 매개되는 신호전달경로를 활성화시키는 것을 나타낸다.
또 다른 메커니즘으로는 IFNAR에 의해 유도된 STAT activation의 패턴을 조절하는 것이다. ISFG3와 STAT1 호모다이머 활성 사이의 밸런스는 NF-κB kinase-ε (IKKε)의 억제제에 의해서도 조절된다. STAT1의 IKKε에 의한 인산화는 STAT1 호모다이머 형성을 억제하고 이에 따라 ISFG3 형성을 촉진하고 항바이러스 반응을 증가시킨다.
3. 1형 인터페론에 의해 유도되는 전사의 조절
JAK-STAT 신호전달의 고전적 모델을 보면, 유전자 활성의 우선적 결정은 STAT의 핵으로의 이동과 해당하는 GAS 요소들과의 직접적인 결합에 의해서 결정된다. 1형 인터페론의 경우에는 ISFG의 형성 그리고 이것의 ISRE에 대한 결합이 포함된다. 이러한 모델은 1형 인터페론의 신호전달을 완벽하게 설명하지 못하고 STAT과 ISFG3에 의해 유도된 유전자의 전사가 몇 가지 단계에 의해 조절됨이 밝혀졌다.
1) 핵 안에서의 STAT의 번역 후 변형 (post-translational modification)
2) STAT과 다른 전사인자들과의 협동을 통한 조절
3) STAT의 해당 타깃 유전자들에 대한 접근을 조절하는 타깃 유전자 전위에서의 후생유전적 인자와 염색질 상태에 의한 조절
4) STAT과 co-activator, co-repressor, 염색질 변형 복합체, 전사 신장 인자들과의 상호작용을 통한 조절
5) Enhancer와 같은 먼거리에서의 조절 요소들과의 STAT의 결합에 의한 조절
3.1 번역 후 변형 (Post-translational modification)
밑에 언급된 대로, STAT의 tyrosine, serine 인산화는 세포질에서 발생하지만 STAT의 serine 인산화는 핵에서도 발생한다. 그리고 이 것은 아마 타깃 유전자 전위에서 나타난다고 볼 수 있다. 이러한 인산화는 STAT1이 DNA에 결합한 후에 cyclin-dependent kinase 8 (CDK8)에 의해서 부분적으로 매개된다. STAT은 또한 아세틸화, 메틸화, sumoylate가 되며 이러한 변형이 어떻게 조절되며 IFNAR에 의한 유전자 활성에 어떤 조절을 하는지에 대해서 밝혀지는 것이 중요하다.
3.2 다른 전사 인자들과의 협동
STAT의 다른 전사인자들과의 관계에서 가장 잘 밝혀져 있는 것은 IRF family의 멤버들이다. 대부분의 IRF에 의해 인식되는 DNA 서열은 ISRE와 중복되며, 따라서 IRF는 ISGF3와 같은 타깃 유전자에 결합하고 활성화를 시킨다. 또한 IRF1, IRF7, IRF8, IRF9의 발현은 STAT에 의존적인 기작을 통해서 인터페론에 의해 유도되고 그래서 많은 ISG는 GAS와 ISRE, GAS, IRF를 포함한다. 이것은 STAT과 ISFG3가 직접적으로 특정 ISG (IRF1, IRF7, IRF8, IRF9)를 활성화시키는 인터페론에 의해 유도된 유전자 발현의 패러다임을 이끌며 이 IRF들은 ISG의 두 번째 그룹을 활성화시킨다. 중요한 것은 STAT, ISFG3, IRF가 유전자의 프로모터 내의 해당 염기서열에 대한 결합을 조절함으로써 다수의 ISF 유도에 대해 협동적으로 작용한다는 것이다. STAT은 또한 여러 가지 신호전달 경로에 의해 활성화 되는 전사인자들과 협동한다. 예를 들면 STAT은 여러 가지 PRR과 염증 싸이토카인에 의해 활성화되는 NF-κB와 상호작용한다. 이것은 타깃 유전자의 증가된 유도 혹은 상승된 유도를 가능하게 하고 타깃 유전자 프로모터에서 STAT과 NF-κB의 GAS와 NF-κB 사이트 에 대한 결합을 조정하는 것에 의해 매개된다. 1형 인터페론 반응은 전사 억제제에 의해서도 억제된다. 비록 근접한 동일한 세포의 군집 내에서 모든 세포가 바이러스에 의해 감염되었거나 1형 인터페론을 생산하는 미생물의 부산물에 노출되거나 ISG를 발현하는 것은 아니다. 확률성의 생물학적 목적은 불분명하지만 몇 가지 증거들은 이것이 ‘mass IFN producer’라는 세포를 생성한다고 나타낸다. 이러한 mass IFN producer들은 감염을 박멸하는데 도움을 주지만 조직의 생존율을 유지하기 위해 low IFN producer들이 보존되는 동안 세포사멸에 대해 더 영향을 받기 쉬워진다.
3.3 염색질 리모델링
유전자의 발현은 히스톤 옥타머가 DNA에 결합하고 전사인자 결합과 Pol II 확장을 막는 뉴클레오솜 배리어에 의해서 억제된다. 유전자 발현이 유도될 수 있기 전에 이 배리어는 히스톤의 번역 후 변형을 통해서 반드시 극복되어야 하고 ATP 의존적인 리모델링 복합체에 의해서 뉴클레오솜들의 위치를 다시 잡거나 제거를 통해 해결되어야 한다. 1형 인터페론에 의한 ISG의 유도는 염색질 리모델링이 필요한데 이 것은 STAT1, STAT2, IRF에 의한 뉴클레오솜 리모델링 효소와 히스톤 아세톤기전달효소 (histone acetyltransferase, HAT)를 이용하여 일어난다 (그림 4). 특히 뉴클레오솜의 조절 지역 근처에 위치한 히스톤 H3, H4에서 히스톤 라이신 아세틸화 (histone lysine acetylation)은 전사 활성과 관련된다. 유도에 의해 프로모터는 HAT와 연관되며 히스톤의 아세틸화가 증가되는데, 아세틸화는 STAT1, STAT2 의 전사활성부위와 상호작용을 통해 HAT-p300, CREB 결합 단백질 (CBP), GCN5를 모아 이루어진다. 다른 전사인자들과 비슷하게, ISGF3는 일반 전사 장치들과 상호작용을 매개하는 co-activator, co-repressor와 상호작용하고 HAT, HDAC, 히스톤 메틸전달효소 (histone methyltransferase)와 같은 염색질을 변형하는 효소들의 모집을 촉진한다. 활성화된 STAT1 단백질 억제제 (protein inhibitor of activated STAT1, PIAS1) 는 작은 유비퀴틴 관련된 modifier (small ubiquitin-related modifier, SUMO) ligase이다. 이 것은 STAT1이 DNA에 결합하는 것을 막고 음성적 히스톤 mark의 ‘writer’를 동원하기 위해 co-repressor로써 역할을 함으로써 STAT1의 기능과 ISG 발현을 억제한다.
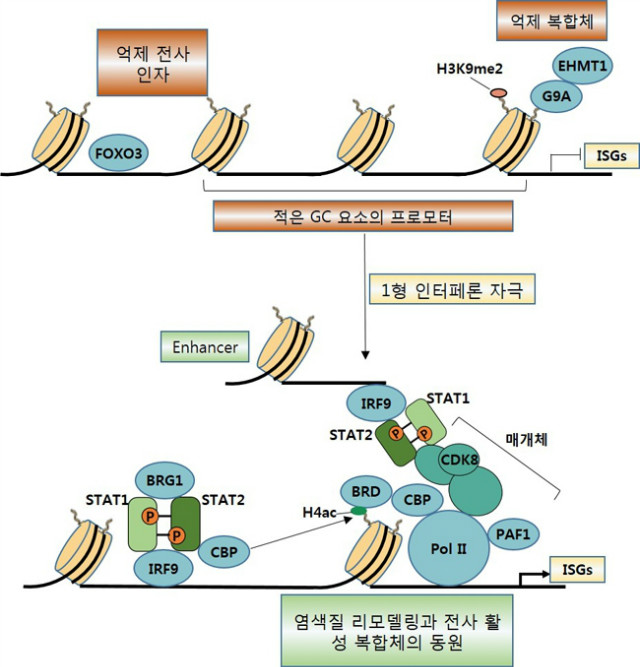
그림 4. 염색질 리모델링과 다양한 전사조절인자의 동원을 포함한 ISG의 1형 인터페론 유도
3.4 전사 신장
ISG의 전사 신장도 조절된다. 1형 인터페론에 의해 매개되는 자극 뒤에 음성 신장 인자 (negative elongation factor, NELF)와 DRB sensitivity-inducing factor (DSIF) 단백질은 전사적 결과를 억제하기 위해 ISG에 모집된다. ISG 전위에서의 전사 신장은 Pol II-associated factor 1 homologue (PAF1) 복합체에 의해서 촉진된다.
3.5 후생유전학적 상황
STAT과 ISFG3는 조절 요소들을 활성화시키기 위해 염색질을 리모델링 할 수 있지만, 무엇이 STAT의 어느 부분에 먼저 결합하는지에 대해 결정하는지는 모른다. 요즘의 패러다임은 세포 분화 중에 계통을 결정하는 전사인자가 특정 조절인자에 대한 접근을 허용함으로써 세포 유형에 특이적인 조절 관련 상황을 만들어낸다는 것이다. 바꿔 말하면, 접근이 가능한 염색질의 조절적 상황이 STAT과 같은 신호에 의해 활성화되는 인자들의 결합패턴을 결정한다는 것이다. 따라서 STAT1은 후생유전학적 상황을 바꿀 수 있다. 그리고 이 것은 뒤이은 자극에 대한 세포 반응을 조절할 수 있음을 의미한다.
4. 1형 인터페론 반응의 번역 조절
1형 인터페론의 항바이러스 기작은 번역에 대한 글로벌한 억제로 이는 바이러스의 단백질 생산을 억제하고 바이러스의 증식을 억제하는 것이다. 1형 인터페론은 핵심 번역 인자 중에 하나인 eukaryotic translation initiation factor 2A (elF2A)를 인산화시켜 불활성화시키는 PROTEIN KINASE RNA-ACTIVATED (PKR) 같이 직접적으로 번역을 억제하는 ISG를 유도하는 것에 의해 부분적으로 번역을 저해한다. 중요한 질문 중 하나는 ISG들과 같은 기주의 방어의 effector의 번역이 어떻게 유지가 되고 글로벌하게 번역이 저해되는 세팅이 어떻게 조절되는지 이다. 비록 1형 인터페론이 아주 넓게 번역을 억제하기는 하지만, 특정한 세포 유형에서는 PI3K-AKT-mTOR 신호전달을 활성화시켜 번역을 촉진하기도 한다. IFNAR-mTOR 신호전달은 elF4 번역 개시 인자의 활성화를 통해 선택된 ISG의 번역을 촉진한다. IFNβ는 바이러스와 가능한 기주의 전사체를 타깃하여 항바이러스 상태에 기여할 수 있는 다양한 miRNA의 발현을 유도하여 번역을 감소시키고 분해를 증가시킨다. STAT1, STAT2, IFNβ 전사체를 타깃으로 하는 몇 가지 세포 내의 miRNA가 1형 인터페론, PRR, 염증 싸이토카인 신호전달에 의해 유도된다. 따라서 1형 인터페론에 의해 유도된 miRNA는 피드백 억제에 참여하고 1형 인터페론 반응에 상호 조절하는 다른 인자들에 의해 유도된다. ISG에 의해 코딩된 단백질은 타깃 특이적 전사체나 넓은 범위의 번역을 억제할 수 있다. 기본적 번역 장치의 넓은 범위의 억제는 IFN-induced protein with tetratricopeptide repeats 1 (IFIT1) 과 IFIT2를 위한 증거를 제공한다. 따라서 1형 인터페론 반응 동안 ISG의 번역은 그들의 mRNA안에 존재하는 특이한 서열에 의해서 조절될 수 있다. OASL1 발현은 1형 인터페론의 자극 뒤에 증가하기 때문에 이것은 1형 인터페론 반응의 지속시간이나 강도를 제한하는 음성 피드백 과정을 나타낸다.
5. 만성 인터페론 반응의 조절
급성 바이러스 감염이 발생한 동안 나타나는 1형 인터페론의 항바이러스와 면역 자극 특성은 상당히 잘 정립되어 있다. 그리고 그 방어적이고 해로운 역할에 대해서도 이미 보고가 되어있다. 하지만 다양한 자가면역질환과 만성적 바이러스, 진균 감염에 대해서는 1형 인터페론의 역할이 잘 알려져 있지 않다. 만성적 1형 인터페론 반응에는 systemic lupus erythematosus (SLE), Sjogren’s syndrome, systemic sclerosis, myositis and rheuma- toid arthritis들이 있다. 여기에서는 이들 만성질환에서 인터페론의 역할, 질병의 복합적 미세환경에 의한 인터페론의 반응의 조절이 병리 발생에 미치는 영향에 대해서 주로 논의한다.
5.1 자가면역질환에서의 1형 인터페론의 기능
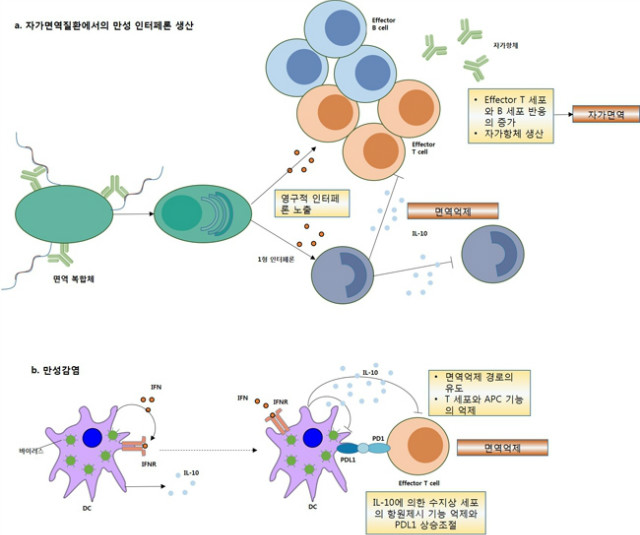
일반적으로 1형 인터페론은 자가면역질환에서 항원제시나 임파구 반응을 촉진하거나 케모카인 발현을 유도함으로써 병리적 역할을 한다고 알려져 있다 (그림 5a). 게다가 골수성 세포 (SLE를 포함한 몇몇 자가면역질환에서)는 STAT1의 증가된 수준의 발현이 나타나는데 이는 인터페론 반응의 증가를 위한 프라이밍 기작을 말한다. 따라서 인터페론에 의한 프라이밍은 자가면역질환에서 염증 인자들에 대한 세포 활성과 반응성의 증가에 기여할 수 있다. 그러나 인터페론은 자가면역질환에서 방어, 보호적 기작을 하기도 한다. 게다가 1형 인터페론은 관절염이나 염증성 장 질환과 같은 자가면역 질환에 대해 동물모델에서 보호적 역할을 나타내 보였고 다발성경화증에서 치료효과를 관찰하기도 했다. 요약하자면 1형 인터페론은 자가면역질환에서 해로운 효과와 보호적 효과를 둘 다 가질 수 있다 (그림 5a).
5.2 TNF와 인터페론 신호전달경로 사이의 교차조절
1형 인터페론과 질병의 발병을 일으키는 염증 전 싸이토카인 간의 교차조절은 자가면역질환에서 1형 인터페론의 역할을 규정한다. 예를 들면 류마티스 관절염이나 염증성 장 질환과 같은 인간 자가면역질환에서 병원성을 가지는 싸이토카인, 1형 인터페론, TNF에 의해 유도된 신호전달 경로의 견고한 상호작용이 존재한다. 1형 인터페론과 TNF가 상대의 발현을 서로 억제하며 TNF의 차단은 환자의 혈액 내에 존재하는 인터페론을 불러일으킨다. 이 사실에 근거하여 이 두 가지 싸이토카인 사이의 불균형은 TNF, 인터페론의 활성이 조절되지 않은 과도한 상태를 일으키며 그 결과 자가면역질환의 병리적 특징을 일으킨다. 따라서 TNF에 의한 1형 인터페론의 반응 조절은 류마티스 관절염 같은 자가면역질환에서 인터페론이 병원성 역할과 보호적 역할 사이의 균형을 결정하게 될 것이다.
5.3 1형 인터페론에 의해 매개되는 면역억제
1형 인터페론은 LCMV, 결핵균, Mycobacterium tuberculosis 와 Mycobacterium leprae 감염의 만성화 단계에서 억제적 역할을 우선적으로 가지게 된다 (그림 5b). 인터페론은 IL-10과 programmed cell death 1 ligand (PDL1)과 같은 억제인자를 유도한다. 1형 인터페론에 의해 매개된 증가된 IL-10 생산은 또한 M. tuberculosis 감염의 쥐 모델에서 질병의 약화에 기여한다. 1형 인터페론의 세포 증식 억제 효과도 만성 감염에서 면역 억제에 기여한다. 그래서 1형 인터페론에 의해 유도된 면역억제 기작은 넓게 다양한 만성 감염에서 영향을 미친다. 이러한 연구들은 1형 인터페론의 만성 감염에서의 역할 뿐만 아니라 1형 인터페론을 막는 치료와 같은 역설적인 생각 또한 특정 면역을 증진시키고 만성 감염 치유를 촉진할 수 있다는 것을 제시한다. 앞선 연구들은 급성 감염 중 항균성 및 면역 자극성으로부터 추후의 만성 감염 단계에서 면역 억제성으로의 기능 전환이 어떤 1형 인터페론의 기능에 의해 나타나는지 보여준다.
그림 5. 자가면역질환과 만성감염에서의 영구적 1형 인터페론 노출의 면역억제 경로 유도
6. 맺음말
수많은 싸이토카인들과 유사하게, 1형 인터페론은 항바이러스 상태를 유도하고 면역반응을 촉진하는 신호의 활성화가 나타나는 균형 잡힌 반응을 유도한다. 이 반응은 만성적 병원균과 같이 존재가 가능하고 기주의 독성을 제한하는 억제적 신호에 의해 상쇄되는 균형 잡힌 반응을 보여준다. 이러한 균형 잡힌 반응은 신호전달, 전사, 번역을 포함한 여러 단계에 걸친 기주 인자들에 의해 잘 조절되어 기주의 보호와 생존에 적절한 면역반응을 만들어낸다. 게다가 1형 인터페론 반응의 조절장애는 자가면역질환을 일으키게 된다. 이것은 1형 인터페론이 병리적으로 작용하는 SLE같은 자가면역질환에 대해 특히 중요하며, 1형 인터페론의 예상치 못한 면역 억제 역할이 최근에 밝혀진 만성 감염에서도 중요하다. 1형 인터페론 반응 조절에서의 후생유전학의 역할, non-coding RNA번역 조절과 세포 대사 등이 미래의 연구분야가 될 것이다. 이러한 분야에서의 발전은 인터페론에 의해 매개된 기주 방어에서는 완벽하지만 1형 인터페론의 반응에서의 병리학적인 요소만을 선택적으로 타깃하여 목표로 하는 치료법 개발에 도움이 될 것이다. 또한 genome-wide analysis를 포함한 새로운 기술들이 1형 인터페론 반응에 대한 포괄적인 연구를 약속할 것이며 타깃 치료의 개발을 도울 것이다.




 pdf_0002378.pdf
pdf_0002378.pdf