BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공지난해 미 FDA 신약 승인 59건으로 역대 최다
- 등록일2019-02-07
- 조회수7553
- 분류기타 > 기타, 제품 > 바이오의약
-
발간일
2019-01-31
-
키워드
#미 FDA#2018#신약 #승인
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 19-9
지난해 미 FDA 신약 승인 59건으로 역대 최다
◇ 미국 식품의약국(FDA)의 2018년 신약 허가건수는 59건으로 2017년 46건 보다 13건이 증가하며 역대 최다 승인건수를 기록. 희귀의약품 지정 등 신속심사 및 허가제도(신속심사, 획기적치료제 지정, 우선심사, 가속승인)의 적극적인 활용으로 승인건수가 크게 증가한 것으로 분석
▸주요 출처 : FDA‘s CDER(CENTER FOR DRUG EVALUATION AND RESEARCH), Advancing Health Through Innovation : 2018 New Drug Therapy Approval, 2019.1
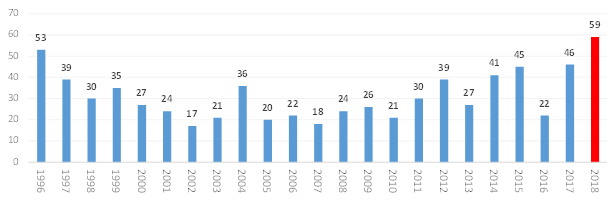
■ 2018년 미국 FDA가 허가한 신약은 총 59건으로 이전 최대치였던 1996년 53건 보다 6건이 많은 승인건수로 최고기록을 세움
○ 미국 FDA의 신약 허가건수는 트럼프 정부 출범 이후 추진된 규제완화 정책으로 신약 승인이 가속화되어 2016년 22건에서 2017년 46건, 2018년 59건의 신약을 승인
- 1996년 53건의 신약이 승인된 이래 최다 승인이며, 승인된 신약 중 바이오신약의 비중은 2014년 이후 30% 수준을 유지
< 미국 FDA 신약 승인 현황(1996~2018) 및 신약 종류별 승인 현황(2008~2018) >
| 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 합계 |
합성신약 (NDA Approvals) | 21 | 20 | 15 | 24 | 33 | 25 | 30 | 33 | 15 | 34 | 42 | 292 |
바이오신약 (BLA Approvals) | 3 | 6 | 6 | 6 | 6 | 2 | 11 | 12 | 7 | 12 | 17 | 88 |
합계
바이오신약 비중(%) | 24 | 26 | 21 | 30 | 39 | 27 | 41 | 45 | 22 | 46 | 59 | 380 |
14.3 | 30.0 | 40.0 | 25.0 | 18.2 | 8.0 | 36.7 | 36.4 | 46.7 | 35.3 | 28.8 | 23.2 |
출처 : FDA, CDER Drug and Biologic Calendar Year Approvals, 2008~2017, FDA(https://www.fda.gov/)
■ 희귀질환 치료제 및 획기적 치료제 지정, 우선심사, 신속심사 등 신약개발 지원제도의 적극적 활용으로 신약 허가가 증가한 것으로 분석
○ 2018년 FDA 의약품평가연구센터(Center for Drug Evaluation and Research, CDER)의 분석결과,
- 신약승인 증가는 도움이 필요한 환자에게 새롭고 혁신적인 치료법을 제공하여 환자 치료 및 국민 건강 향상에 기여한 것으로 평가
- 또한 희귀질환 및 전염병 등 공공성 및 unmet needs가 높은 질환에 대한 신약 허가가 많았던 것으로 조사
※ 희귀질환(Rare Diseases) : 59건의 신규허가 중 34건이 희귀질환 환자 치료 관련 신약으로 구루병, Fabry 질환, phenylketonuria(PKU) 치료제 등 승인
※ 전염병(Infectious Diseases) : 천연두, HIV-1, 말라리아, 인플루엔자(독감), 비결핵성 마이코박테리아 폐질환 치료제 등을 승인
※ 신경학적 장애(Neurological Disorders) : Lennox-Gastaut 증후군 및 Dravet 증후군, 편두통 등 신경학적 장애를 치료할 수 있는 신약 승인
※ 심장, 폐 및 순환기(Heart, Lung, and Circulatory Diseases) : 유전성 혈관 부종 치료제 승인
※ 여성 건강(Women’s Health) : 자궁내막증, 질링 피임약 승인
※ 암 및 혈액질환(Cancer and Blood Disorders) : 유방암, 전립선암, 특정 유형의 암 치료를 위한 신약 승인. 갈색세포종(pheochromocytoma), 갑상선암, 재발성/불응성골수성 백혈병 등을 치료하는 치료제 승인
※ 기타(Other Advances) : 비-오피오이드 제제 및 신경영양각막염(neurotrophic keratitis) 치료제 승인, 새로운 바이오시밀러 7개를 승인
지식
동향


 BioINwatch19-9(1.31)●지난해 미 FDA 신약 승인 59건으로 역대 ...
BioINwatch19-9(1.31)●지난해 미 FDA 신약 승인 59건으로 역대 ...
 미국 FDA 신약 승인 현황(1996~2018) 및 신약 종류별 승인 현황(2008~2018)
미국 FDA 신약 승인 현황(1996~2018) 및 신약 종류별 승인 현황(2008~2018)
 2018년 미국 FDA 승인 신약 리스트(59개)
2018년 미국 FDA 승인 신약 리스트(59개)