BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공개방형 혁신을 통한 신약 사업 리스크 관리와 제언
- 등록일2021-04-30
- 조회수4860
- 분류레드바이오 > 의약기술, 제품 > 바이오의약
-
저자/소속
황지만/딜로이트 안진회계법인
-
발간일
2021-04-30
-
키워드
#혁신#신약#innovation#new drug
- 첨부파일
-
차트+
?
차트+ 도움말
개방형 혁신을 통한 신약 사업 리스크 관리와 제언
황지만 파트너, 딜로이트 안진회계법인
1. A사의 고민
국내 제약회사인 A사는 10년 전 주력 사업이었던 제네릭(복제약)으로는 사업 지속이 어렵다고 판단하여, 신약 개발 프로젝트를 가동하였다. 국내외 전문가를 영입하고, 매출의 5%를 지난 10년간 신약 프로젝트에 투입하였다. 임직원들의 뼈를 깎는 노력을 바탕으로 신약 개발에 매진한 결과 항암신약을 미국 2상에 진입시키는 데 성공한다.
내부적으로는 개발이 성공할 경우 미국에서 연 $1B에 달하는 매출을 거둘 것으로 예상한다. 이 때, 글로벌 제약사 B는 A사의 신약에 관심을 보이며, 제품 도입에 계약금 $20M과 매출의 10%에 달하는 로열티를 제시했다. 지금까지 투자한 기간과 비용을 생각하면 계약금이 턱없이 모자라고, 오랜 기간 공을 들인 것은 A사인데 B사가 모든 과실을 가져가는 것만 같다. 조금만 더 개발을 하면 다른 제약사가 더 좋은 조건을 제시할 수도 있을 것 같고, B사와 수익을 나누는 것보다는 직접 미국 시장에 진출하여 수익을 독차지 하는 계획도 세워 본다. 어떠한 결정이 옳은 선택일까?
2. 신약 개발과 상업화의 높은 리스크
신약 개발의 기간은 약 15년 정도 소요되는 것으로 알려져 있다. 후보물질 탐색부터 시작하여, 전임상시험(동물/세포 대상), 임상(사람 대상, 1~3상)을 거쳐 판매 허가 신청 (New Drug Application)을 하면 규제당국의 검토를 거쳐 시판 승인을 받게 된다. 성공확률은 약 5000 ~ 1만분의 1이다. 소요되는 비용은 출처에 따라 편차가 있지만, DiMasi 등(2016) 에 따르면 신약 1개를 성공적으로 개발하기 위해 약 26억 달러가 소요 된다고 한다. 다만, 이 금액은 신약 한 개를 성공시키기 위해 그 동안 실패 했던 프로젝트 소요 비용과 자본비용 등이 고려된 것으로 1개 프로젝트에 직접 투입된 금액을 의미하는 것은 아니다.
[그림 1] 신약 개발 A to Z
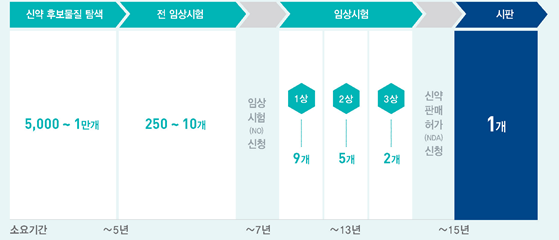
※ 출처 : 한국제약바이오협회, ‘2017 한국 제약산업 길라잡이’
3. 신약 개발 및 상업화에는 매우 큰 리스크가 따른다.
이중 가장 많은 투자를 요구하는 임상 단계를 더 살펴보자. 2006~2015년까지 수행된 1,103개 회사의 7,455개의 임상 프로그램을 미국바이오협회(BIO)가 분석한 결과 임상 1상에 진입한 약물이 승인에 성공하는 확률은 9.6%에 불과하다고 한다.
A사의 경우를 보면, 현재 2상에 있으므로 3상을 거쳐서 승인까지 성공할 확률은 (30.7% X 58.1% X 85.3%) = 15.3%으로 추정해 볼 수 있다. 하지만, 15.3%는 모든 질환군(Therapeutics Area)을 포함한 것이다. 종양학(Oncology) 분야는 다른 영역 대비 성공률이 낮아서 1상에 진입한 약물이 승인 받을 확률은 5.1%이고, 2상에 진입한 약물은 8.1%에 불과하다. 하지만, 낮은 확률을 넘어서 승인을 받는다고 상업적 성공이 보장된 것은 아니다.
[그림 2] Phase Transition success rates and Likelihood of approval from Phase I for all diseases, all modalities
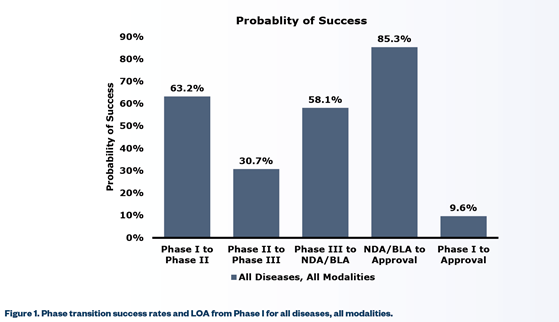
※ 출처 : DiMasi, J. A., Grabowski, H. G., & Hansen, R. W. (2016). Innovation in the pharmaceutical industry: New estimates of R&D costs. Journ al of Health Economics, 47, 20-33.
먼저, 승인 후에도 R&D에 지속적인 투자가 필요하다. 제형 개선, 적응증 추가/확장, 장기안전성연구, 공정 개선 등을 해야 하는데, 신약 가치 극대화를 위해 전략적으로 하는 것도 있고, 규제당국의 요청에 따라 허가권을 유지하기 위한 것도 있다. 약의 효과가 좋다고 스스로 팔리지는 않기 때문에, 영업/마케팅에 막대한 투자도 필요하다.
하지만, 이러한 투자에도 불구하고, 예상했던 매출 또는 수익을 올리지 못할 수 있다. 약가를 낮게 받거나, 허가사항 또는 보험 범위가 예상보다 좁을 경우 매출에 직접적인 타격이 될 수 있다. 기존 제품과의 차별화에 실패할 수도 있고, 경쟁회사에서 동일 시장에 다른 신약을 출시할 수도 있다. 판관비와 생산비 등의 비용이 예상보다 많이 소요되어, 수익이 너무 낮을 수도 있다. 출시 이후에도 안전성 문제로 허가 취소될 가능성도 배제하지 못한다.
이러한 상업화 리스크에도 불구하고, 미국에서 제네릭 출시로부터 보호받는 기간은 약 7~12년 정도인데, 임상시험에서 환자 등록이 지연되는 등의 사유로 개발 기간이 길어질 경우 보호 기간은 짧아질 수 있다. 이런 사항들을 모두 고려하면, 투자금을 회수할 가능성은 매우 낮아 보이는데 계속 자체 개발에 투자하는 것이 과연 현명한 길일까?
지식
- BioINpro [2025 바이오 미래유망기술(하)] 딥 러닝 기반 생성모델의 구조적 원리와 인간 면역데이터 응용 신약개발 전략 2025-06-30
- BioINpro [2025 바이오 미래유망기술(상)] 바이오파운데이션모델: 2025년 주목해야 할 차세대 바이오 혁신 기술 2025-05-19
- BioINwatch 가장 많이 인용된 논문은 혁신적 발견을 이끄는 연구방법과 분석기술에 관한 내용 2025-05-08
- BioINwatch 2050년을 대비한 일본 과학기술 정책, 문샷형 R&D 2025-02-25
- BioINwatch 바이오신약 개발을 혁신할 AI 단백질 언어 모델 2025-02-14
동향


 [BioINPro 89호] 개방형 혁신을 통한 신약 사업 리스크 관리와 ...
[BioINPro 89호] 개방형 혁신을 통한 신약 사업 리스크 관리와 ...
 신약 개발 A to Z
신약 개발 A to Z