기술동향
줄기세포의 역동적 상태: 설치류와 인간에서의 naive, primed 다능성 비교
- 등록일2018-01-09
- 조회수9252
- 분류기술동향
-
자료발간일
2017-07-01
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#줄기세포
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
줄기세포의 역동적 상태: 설치류와 인간에서의 naive, primed 다능성 비교
[목 차]
1. 서론
2. 생쥐의 다능성 상태
3. 인간의 다능성 상태
4. 다능성 상태의 분류
5. 함의와 추후 연구방향
[요약문]
역분화(reprogramming)를 통해 체세포를 다능성줄기세포(pluripotent stem cell)로 유도하는 메커니즘과, 다능성줄기세포를 생체외(in vitro)에서 그 특징을 보존한 채 유지시키는 신호전달경로를 이해하는 것은 매우 중요한 연구분야이다. 이 리뷰에서는 다능성줄기세포의 naive 상태와 primed 상태를 서로 다른 종(species)에서 비교하고, 다능성줄기세포의 상태 변화와 생체 외 - 생체 내 간의 상호전환에 관여하는 메커니즘에 대한 최근 연구를 개관한다. 최종적으로, 아직 해결되지 않은 중요한 질문들을 언급하고 다양한 다능성줄기세포 상태의 활용방법에 대해 짚어본다.
1. 서론
다능성(pluripotency)은 외배엽, 중배엽, 내배엽, 그리고 시원생식세포(primordial germ cell)로 분화할 수 있는 분화능을 가지며, 배아외 기관(extra-embryonic tissues)으로는 분화하지 못하는 상태로 정의된다. 위와 같은 다능성을 갖는 다능성줄기세포는 체내에서 일시적인 상태로 존재하지만, 생체 바깥에서는 몇 가지 외인성 단백질을 추가함으로써 무기한적으로 유지될 수 있다. 다시 말해 다능성줄기세포는 생체 외 조건에서 자기복제(self renewal)를 무제한 반복할 수 있다. 하지만 이러한 자기복제 특성은 다능성줄기세포를 정의하는 특징이라기보다는 초기 발생의 일시적인 특징에 가깝다고 할 수 있다. 자기복제 특성은 조직 교체, 질병 모델링, 동물 공학 등의 목적을 수행하는데 유용한 도구로서 다능성세포의 아주 중요한 특성으로 연구되었지만, 다능성줄기세포는 다능성이라는 측면에서 더 연구될 필요성이 있다고 할 수 있다.
다능성줄기세포는 설치류와 인간을 포함한 척추동물로부터 분리 가능하며 여러 다양한 상태를 갖는다. 다양한 다능성줄기세포의 명칭은 먼저 기원세포의 상태에 따라 달라지는데, 착상 전 배반포(blastocyst)의 내세포집단(inner cell mass)로부터 분리된 것을 배아줄기세포(embryonic stem cells; ESCs), 착상 후 배반엽상층(epiblasts)으로부터 분리된 것을 배반엽상피줄기세포(epiblast stem cell; EpiSCs)라 부른다. 생체 내로부터 얻지 않고 체세포 역분화를 통해 다능성줄기세포를 분리하는 방법 또한 개발되었는데, 이러한 방법으로 유도된 다능성줄기세포로는 난자의 핵을 이용한 핵이식-배아줄기세포(nuclear transfer embryonic stem cells)와, 몇 가지 정의된 인자를 체세포에 직접 과발현하여 만든 유도만능줄기세포(induced pluripotent stem cells; IPSCs)로 나뉜다. 위와 같은 인공적 방법으로 유도된 다능성줄기세포는 유지 환경에 따라 그 상태가 변화하는데, 배아줄기세포 성장 환경에서는 배아줄기세포와 유사한 상태를 유지하게 되고, 배반엽상층줄기세포의 성장 환경에서는 배반엽상피줄기세포와 유사한 상태를 유지하게 된다. 배아줄기세포와 배반엽상층줄기세포는 분화능을 포함한 다양한 측면에서 기능적, 분자적 차이를 보이는데, 배반엽상층줄기세포와 비교하여 배아줄기세포는 배반포에 미세 주입하여 키메라 마우스를 발생시키는 과정에서 발생 과정이 더 많이 참여하게 되며, X염색체 불활성화, 분화 유전자의 제어를 더 잘 유지한다고 알려져 있다. 이러한 차이는 서로 다른 다능성 상태에 대한 정의와 각 종들 사이의 특징을 규명하는 것이 매우 중요하다는 점을 시사한다.
2. 생쥐의 다능성 상태
생쥐의 배아줄기세포는 내세포 집단의 상태와 비슷한 상태를 유지하는 것으로 보이며 이 상태를 naive pluripotency라 부른다. 착상 이후의 배반엽상층세포로부터 얻어진 배반엽상층줄기세포는 배아줄기세포와는 분자적, 기능적 차이를 보이며 이 상태를 primed pluripotency라 부른다.
2.1 Naive pluripotency를 유지하기 위한 성장 조건
생쥐의 배아줄기세포는 30년 전, 129 mouse strain으로부터 유래하여 생쥐 배아 섬유아세포 (mouse embryonic fibroblasts; MEFs)와 소태아혈청(fetal bovine serum; FBS)을 이용하여 배양 조건이 확립되었다. 이 후 JAK-STAT3 pathway를 활성화시키는 Leukemia inhibitory factors (LIF)가 섬유아세포 없이도 배아줄기세포를 유지할 수 있는 배양조건의 요소로 밝혀졌다. 이 후 BMP4와 LIF만으로 혈청과 추가의 섬유아세포 없이도 배아줄기세포를 유지할 수 있는 조건이 확립되었으며, MEK signaling pathway 억제제가 유지 효율을 높인다는 사실이 밝혀졌다. 3i conditions라고 불리는 MEK, FGF, GSK3 inhibitors 조건은 LIF 없이도 배아줄기세포를 유지시키는데 성공했고, 어떠한 외부의 세포신호 자극제 없이도 독립적으로 그 상태를 유지할 수 있어 위 조건에서 배양된 세포의 상태를 ground state pluripotency라 지칭한다. 반면 2i/LIF condition (MEK, GSK3 inhibitors and LIF)은 3i condition에 비해 배아줄기세포의 분열 속도를 높게 유지했고, 이는 자가 분비된 FGF가 MEK-ERK signaling 과 별개로 naive 배아줄기세포의 분열에 영향을 미친다는 점을 시사한다. 놀랍게도, Erk1, Erk2의 유전자가 제거된 배아줄기세포는 유지되지 않았으며, 이 또한 MEK 억제제가 ERK와는 별개로 naive 상태의 안정성에 영향을 미친다는 점을 의미한다.
Naive 상태를 유지하는데 중요한 신호전달경로는 다면성(pleiotropy) 측면에서 한층 더 복잡한데, 이를테면 GSK inhibition은 beta-catenin의 안정화를 통해 TCF3의 작용을 억제하고, E-cadherin을 안정화시켜 naive 상태를 유지하는데 도움을 주지만, 동시에 핵 안에서는 중배엽 분화에 관련한 유전자들의 발현을 증가시켜 naive 상태를 방해하기도 한다. 마찬가지로 LIF도 naive 상태를 유지하는 단백질로 주로 사용되지만, 원시 내배엽(primitive endoderm) 분화 관련 유전자들을 증가시키기도 한다. 이러한 복잡하고 다양한 다능성 조절 메커니즘은 따라서 체계적이고 종합적인 방법으로 접근할 필요성을 시사한다.
2.2 Primed pluripotency를 유지하기 위한 성장 조건
배반엽상층줄기세포는 착상 이후 배반엽상층에서 유래하며 FGF2/Activin A condition에서 유지된다. 배반엽상층줄기세포는 세가지 배엽으로 분화할 수 있는 분화능을 역시 가지지만 배반포 삽입을 통화 키메라 생쥐의 발생에 관련해서는 배아줄기세포보다 낮은 효율성, 기여도를 보인다. 또한 배반엽상층줄기세포는 OCT4, SOX2의 발현양을 높게 유지하지만, NANOG, ESRRB, KLF2, KLF4 등의 유전자에 대해선 낮은 발현양을 보인다. 대신 OTX2, ZIC2 등과 같은 분화에 관여하는 유전자들의 발현양이 상대적으로 증가되어 있고, 기능적으로는 X염색체불활성화가 진행되어 있다. 또한 histone H3 lys27 trimethylation (H3K27me3)과 enhancer의 배치가 배아줄기세포의 그것들과 많이 다르다.
배반엽상층줄기세포의 성장 컨디션은 FGF2/Activin A를 처리해주는 조건이며 대안적으로는 GSK3i와 tankyrase 저해제 IWR1을 처리하는 조건으로, beta-catenin을 비활성화 시켜 FGF2/Activin A 없이도 primed 상태를 유지할 수 있게 한다. 그러나 GSK3i/IWR1 condition이 FGF2/Activin A condition 보다 naive pluripotency 표지유전자를 높게 유지시킨다는 결과로 미루어보아 GSK3i/IWR1 conditioin이 배반엽상층줄기세포를 상대적으로 덜 primed한 상태로 유지시키는 것으로 보인다. 흥미로운 것은 이렇게 서로 다른 primed 상태가 착상 후 배아의 위치 별 특성을 대변한다는 것이다. 이를테면, FGF2/Activin A condition에서 자란 배반엽상층줄기세포는 전부 낭배원시선 세포(anterior late-gastrula primitive streak cells)의 특성을 보이며, FGF2/IWR1 condition에서 자란 배반엽상층줄기세포는 후경 배반엽상층 세포(posterior-proximal epiblasts)의 특성을 나타낸다. 마지막으로 primed condition에서 노출된 시간이 배반엽상층줄기세포의 특징과 기능을 변화시킨다. FGF2/Activin A condition에서 7일 이상 노출된 생쥐의 배반엽상층줄기세포는 원시생식세포(primordial germ cell)로의 분화능을 상실하며, naive 상태로부터 primed condition에 2~4일 노출된 세포들만이 원시생식세포로 분화하는 것이 확인되었다. 이러한 발견에 대해서는 추후 단일세포 분석을 통해 보다 상세한 분화메커니즘과, 최적 분화 프로토콜을 확립할 수 있을 것으로 기대된다.
2.3 Naive 상태와 primed 상태 간의 상호 전환
체세포에 pluripotency factors를 과발현시켜 naive 상태를 유도할 수 있는 것과 같이 primed 다능성줄기세포 또한 naive 상태로 변환될 수 있다. LIF를 함유하는 배양 조건에서 KLF4 혹은 MYC을 과발현시켰을 때 naive 상태가 되는 것이 확인되었으며, 129 strain과 같은 생쥐로부터 유래한 배반엽상층줄기세포의 경우 FBS/LIF 신호전달 만으로도 naive 상태로의 전환이 가능했다. 하지만 상대적으로 덜 허용적인(non-permissive) NOD mice의 배반엽상층줄기세포의 경우 2i condition (GSK3, MEK inhibitors)이 추가적으로 더 요구되었다. 이 외에도 NANOG, PRDM14, ESRRB 등이 naive 상태로의 전환 효율성에 상승효과(synergistic effect)를 보였다. 또한 반대의 경우, 즉 naive한 상태에서 primed 상태로의 전환은 primed condition을 통해 점진적으로 이뤄지는 것이 확인되었다. Primed 상태로의 전환에 초점을 맞춘 연구들은 naive 상태와 primed 상태의 상호 전환의 중요한 분자적 변화를 발견하였는데, 2i/LIF 조건에서 유지되던 naive 배아줄기세포를 FBS/LIF 조건으로 바꾸어 주었을 때, DNA promoter와 gene bodies 상에 methylation level이 광범위하게 증가하고, 그와는 반대로 promoter와 enhancer 조절 위치에서는 methylation이 일어나지 않는 것을 확인하였다. 이 위치에서의 methylation은 FGF2/Activin A 조건을 처리한 이후에 증가하는 것 또한 확인되었다.
FBS/LIF condition에서의 priming은 먼저 OCT4, SOX2, NANOG 등의 pluripotency factors의 promoter의 점유도를 줄인다. 대신 H3K27me3의 점유율이 높아지고, 이는 enhancer landscape에 변화를 주어 결과적으로는 전사인자들의 부착 패턴을 변화시킨다. 뒤이어 DNA methyltransferase enzymes의 발현양이 줄어들면서 전반적인 DNA methylation level이 줄어든다. 주의해야 할 것은 naive 상태에서 DNMT3A, DNMT3B 등의 DNA methyltransferase를 제거하였을 때 급격한 DNA methylation 감소가 일어나지는 않는다는 점인데, 이는 아직 알려져 있지 않은 분자메커니즘이 관련되어 있다는 점을 시사한다. 최근 연구에 따르면, MEK-ERK 억제는 Polycomb repressive complex 2(PRC2)의 활동을 억제하고 RNA polymeraseⅡ의 인산화 정도를 감소시켜, 결과적으로 분화에 관여하는 유전자들 loci의 H3K27me3를 감소시키고, 동시에 RNA polymeraseⅡ의 활성도를 증가시킴으로써 분화를 촉진한다.
3. 인간의 다능성 상태
3.1 통상적 인간 다능성줄기세포(Human conventional pluripotent cells)
최초의 인간 배아줄기세포는 생쥐와 마찬가지로 배반포로부터 유래하였지만, 그 자체의 특징과, 배양 조건에서 생쥐의 배아줄기세포와는 많은 차이를 나타냈다. 생쥐의 배아줄기세포와는 달리 FGF2와 transforming growth factor β1 (TGFβ1)/Activin A 신호전달이 생체 바깥에서 인간 배아줄기세포 혹은 역분화줄기세포를 유지하는데 필수적이다.
? A primed pluripotent state
다양한 계통의 생쥐로부터 얻어진 배아줄기세포의 연구는 각 계통 별로 최적의 naive 유지 조건이 있다는 점을 발견했다. 예를 들어, NOD mice로부터 유래된 배아줄기세포는 129 mice로부터 유래된 배아줄기세포와는 달리 2i/LIF를 반드시 필요로 한다. 달리 말해서 이는 naive 상태를 유지하기 위한 최적의 condition이 갖춰지지 않는다면 배아줄기세포가 생체 외 배양 시 primed 상태로 변할 수 있다는 가능성을 시사한다. 이러한 측면에서, 통상적인 인간 배아줄기세포는 부적절한 배양 조건으로 인해 primed pluripotency를 유지하는 것으로 판단된다. 이러한 특징으로는 naive pluripotency markers의 낮은 발현율, 발생에 필요한 유전자 loci에 위치한 높은 레벨의 H3K27me3, 전사인자 tranion factor E3 (TFE3)의 세포질 상의 위치적 특징, MEK-ERK 저해에 의한 다능성 상실, hypomethylation의 결핍, X염색체 불활성화 등이 포함된다.
하지만 인간 배아줄기세포의 위와 같은 특징에도 불구하고, 통상적인 인간 배아줄기세포가 생쥐의 배반엽상층줄기세포와는 같은 성질을 보인다고 할 수는 없다. 인간 배아줄기세포는 생쥐의 배반엽상층줄기세포보다는 덜 primed 되어 있는 상태라고 하는 것이 적절하다. 예를 들어, 인간 배아줄기세포는 생쥐의 배반엽상층줄기세포에서 높게 발현되는 FGF5 혹은 N-cadherin등을 높게 발현시키지 않으며, 오히려 생쥐의 naive 배아줄기세포에서 높게 발현되는 E-cadherin을 높게 유지한다. 그리고 NANOG, PRDM14, REX1 등의 naive pluripotency factors의 발현양이 높다. 또한, DNA methylation의 패턴은 FGF2/Activin A 조건에서 배양된 생쥐의 배반엽상층줄기세포보다 FBS/LIF조건에서 배양된 naive 배아줄기세포의 것과 더 흡사하며, TFE3의 세포질-핵의 위치 패턴도 naive 배아줄기세포와 일치한다.
3.2 Naive 인간 다능성줄기세포
? Transgene-dependent generation
2i/LIF condition은 인간의 배아줄기세포 혹은 역분화줄기세포의 naive 상태를 유지시키는데 불충분하다. 이는 추가적인 전사인자 과발현을 통해 가능한데, 이를테면 OCT4/KLF4, KLF2/KLF4 등을 지속적으로 과발현시켜 주었을 때 고유한 naive 상태를 유지하게 된다. 최근에는 2i/LIF condition 혹은 2i/LIF/aPKCi condition에서 NANOG와 KLF2의 발현양을 최적화시킴으로써 naive한 인간 역분화줄기세포의 증폭이 가능하다는 점이 보고된 바 있다. 이러한 세포들은 광범위한 DNA hypomethylation 특성을 가지며, TFCP2L1, KLF2, KLF4와 같은 pluripotency markers를 높게 유지한다. 그러나 인간의 내세포 집단의 세포들이 KLF2를 발현하지 않는다는 점, 유전자를 전이시키지 않고 배양 조건만으로 primed 상태를 naive한 상태로 되돌리지 못했다는 점 등을 고려했을 때, 위와 같은 naive 상태가 무기한적으로 안정적인 상태인지는 불투명하다고 볼 수 있다. 뿐만 아니라 위 상태의 세포들의 DNA methylation 패턴을 조사하였을 때, 광범위한 imprinting의 손실이 있었으며, endogenous retroviral genes의 과도한 DNA hypomethylation이 확인되었다. 마지막으로 naive 인간 배아줄기세포를 유지하는 조건에 FGF 혹은 TGFβ1/Activin A 등이 포함되지 않음에도 불구하고 FGFR나 TGFR를 저해하였을 때 영향을 받는 것으로 보았을 때, 이러한 세포 상태가 생쥐의 naive 상태와는 달리 FGF, TGF, Activin A 신호전달과 관련이 있을 수 있음을 의미한다. 실제로 인간의 내세포 집단은 생쥐의 내세포 집단과는 달리 TGF, activin-NODAL 신호전달 억제를 통해 분화된다고 알려져 있다. 결론적으로, 최근 연구 방법이 유전자전이를 배제한 배양 조건 확립으로 옮겨 가고 있지만 생쥐의 naive 상태가 생쥐 특이적인 현상일 수 있다는 점을 가정한다면 유전자전이를 통한 연구가 여전히 중요하다고 할 수 있다. 뒤이어 소개될 연구 결과들은 또 다른 다능성 상태를 인간 세포에서 생성할 수 있는 가능성을 제시하는 결과들이다.
? Transgene-independent generation
본 리뷰의 저자의 연구팀은 최초로 인간의 naive pluripotency 성장 조건을 확립한 바 있다 (naive human stem cell medium; NHSM). 위 성장 조건엔 2i/LIF와 함께 p38 inhibitor, Jun N-terminal kinase inhibitor, aPKCi, RHO associated protein kinase 1 inhibitor, 적은 농도의 FGF2, THFβ1(혹은 Activin A)가 포함된다. 이 조건 속에서 인간의 다능성줄기세포는 생쥐의 naive 다능성줄기세포와 완벽히 같지는 않지만 매우 흡사한 특징을 보인다. 그러한 특징으로는 TFE3의 세포 내 위치, 발생 관련 유전자들의 H3K27me3 demethylation 등이 포함되며, OTX2, ZIC2, CD24 등의 분화 관련 마커들의 낮은 발현양, pluripotency genes의 높은 발현양 등의 특징이 또한 포함된다. 또한 이 세포들은 DNMT3B를 낮은 발현시킴으로써 global DNA methylation을 낮은 수준으로 유지함과 동시에 imprinting과 염색체안정성(chromosomal stability)은 정상적으로 유지한다. 인간의 다능성줄기세포의 경우 키메라 분석은 윤리적, 법적 문제로 금지되어 있지만, 생쥐의 상실배(morula)에 미세주입함으로써 E10.5-E17.5까지 기관 형성에 기여하는 것이 관찰되었다. 이후 확립된 다른 조건 중 MEF 배양보조세포 (feeder cell)와 함께 2i/LIF, ROCKi, BMP receptor inhibitor, 높은 농도의 FGF2, TGFβ1를 함유한 배지조건이 있으며 위 조건에서 배양된 다능성줄기세포는 STELLA, KLF5 등과 같은 pluripotency markers를 높게 유지하였다. 이 외에도 NHSM과 기본적 구성이 비슷하지만 BRAF, SRC pathway의 저해제를 추가한 조건(5i/LA-MEF conditions)도 있었다. 하지만 5i/LA-MEF condition의 경우 pluripotency markers 의 더욱 분명하게 증가된 발현양이 확인된 반면, DNMT3B가 감소하질 않는 문제, X염색체 불활성화 등의 한계를 가지고 있었다.
위의 언급된 배양 조건들은 인간의 다능성줄기세포들을 생쥐의 배아줄기세포나 인간의 내세포 집단의 세포들과 일치하는 상태로 유지할 수 있다는 것을 보여주었고, 새로운 세포 신호 전달 경로가 인간 배아줄기세포의 naive 상태에 관여되어 있다는 사실을 시사했다. 그 밖에 인간배아줄기세포에서 RAF, aPKC 조절과 GSK3i/IWR1 조건을 통한 WNT 신호 전달 조절 사이에 메커니즘적 관련성이 있을지 확인해 보는 것도 흥미로운 연구가 될 것이다. 또한 RHO 신호 전달이 YAP, TAZ 단백질의 핵으로의 이동을 증가시켜 다능성을 유지시킨다는 보고와 관련하여 ROCKi가 naive 상태를 유지시키는 메커니즘이 YAP, TAZ 단백질을 통한 것인지 확인해보는 것도 필요할 것이다.
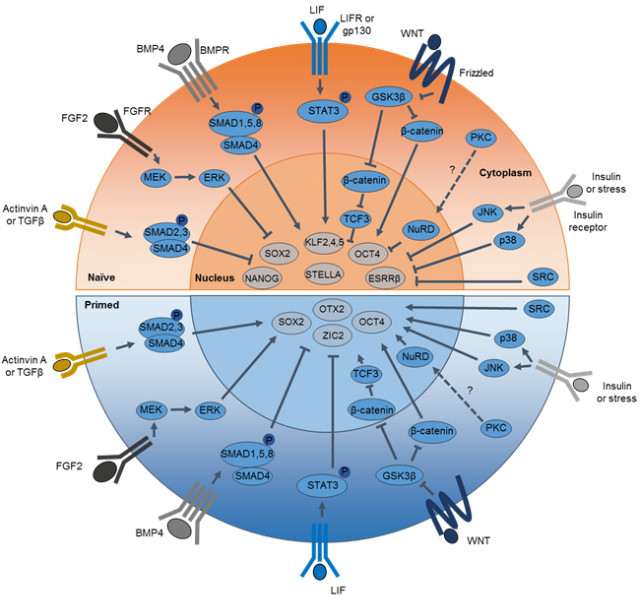
* 인간의 다능성줄기세포에서 Activin A, TGFβ, FGF2, BMP4, SMAD, β-catenin은 작용 메커니즘이 다를 수 있음.
그림 1. 다능성줄기세포의 Naive, primed 상태와 관련한 신호전달경로와 그 영향
3.3 생쥐와 인간의 배반엽상층의 차이
최근 단일세포 RNA 시퀀싱 실험을 통해 착상 전 인간 배아 상태에 대한 중요한 부분들이 밝혀지기 시작했다. 이 결과들에 따르면 비록 인간 배반포와 생쥐의 배반포가 형태학적으로 큰 차이를 보이지 않지만 세포 수준에서 분자적 변화들이 분명하게 존재한다. 인간 내세포 집단의 배반엽상피줄기세포는 생쥐하고는 다르게 KLF2, ESRRB를 발현하지 않으며, 대신 KLF17을 발현한다. 또한 RAS 단백질의 배아줄기세포 특이적 단백질 이소형인 ERAS는 인간에서는 위유전자(pseudogene)이지만 생쥐의 배아줄기세포는 ERAS가 제거되었을 때 성장 속도가 느려진다. 인간 외의 영장류의 배반엽상피줄기세포도 생쥐보다는 인간의 것과 흡사한 성질을 보이며, 마모셋(marmoset)의 경우 인간과 마찬가지로 KLF2를 포함하여 NR0B1, BMP4 등을 발현하지 않고 대신 NODAL 단백질의 높은 발현양을 유지한다. 착상 이후에는 설치류와 인간 배아 사이에는 형태학적으로도 큰 차이가 생겨나는데, 설치류의 경우 계란 모양의 원통형 모양을 갖추는 반면 인간의 경우 납작한 디스크 모양을 띤다. 착상 후 인간의 배반엽상층 세포들을 단일 세포 분석하는 것은 불가능하지만, 다른 영장류의 배반엽상층을 통해 확인하였을 때, 이들은 분명히 다른 다능성 상태를 보이며, 생체 외에서 배양될 때 각기 다른 성장 요건을 필요로 한다는 것이 확인되었다.
4. 다능성 상태의 분류
우선, 여러 다능성 상태를 정의하기 위해서는 소수의 마커 유전자의 발현양을 확인하거나 기능적 분석을 하는 것 만으로는 부족하며 체계적인 분석이 필요하다. 하지만 그럼에도 불구하고 본 리뷰의 저자들은 MEK 저해에 대한 세포의 반응성을 naive와 primed pluripotency의 구분의 기준으로 제시하고자 한다. 통상적인 인간 배아줄기세포와 생쥐의 배반엽상층줄기세포는 MEK 저해 시 즉각적으로 분화하지만 naive 다능성줄기세포의 경우 MEK 저해제에 대해 반응하지 않는다. 이와 비슷하게 METTL3, DNMT1, DGCR8, MBD3 와 같은 후성적 리프레서(epigenetic repressors)들을 제거하였을 때 세포가 그 상태를 유지하는지 확인하는 것도 naive 상태를 판별하는 방법이 될 수 있다. 하지만 주의해야 할 점은 다양한 naive, primed 상태가 존재한다는 점이다. 다시 말해서 다능성 상태가 ‘조금 더 naive’하거나 ‘조금 더 primed’된 상태로 존재할 수 있다는 것이다. 인간의 primed 배아줄기세포는 DNA methylation과 NANOG 의존성 등의 측면에서는 naive 상태의 특징 역시 가지고 있으며, 생쥐의 배아줄기세포의 경우 FBS/LIF에서 배양되었을 때 키메라 마우스 발생 측면이나, Dnmt1, Mettl3 제거 시의 세포 상태 측면에서는 naive 상태의 특성을 충분히 보유하지만 DNA methylation이나, H3K27me3의 패턴에 관해서는 2i/LIF에서 배양된 줄기세포보다 덜 naive한 특성을 나타낸다.
5. 함의와 추후 연구방향
체세포를 이용한 역분화줄기세포의 발견은 다능성 상태에 대한 깊은 연구를 가능하게 했으며 다능성 상태를 인공적으로 변화시킬 수 있음을 밝혔다. Naive 상태와 primed 상태의 구분이 존재하는 것은 발생 단계에서 다능성을 효율적으로 관리하고 각 조직으로의 분화를 최적화하기 위함으로 보이며, naive pluripotency는 분화 과정에서 발생하는 후성적인 특성을 완전히 제거한 단계로 가정해 볼 수 있다. 따라서 이러한 상태의 다능성줄기세포는 신호전달경로로부터 상대적으로 덜 민감한 상태를 유지하며 분화 자극에 대해서도 즉각적으로 반응하지 않고, 착상 이후 점진적으로 변화하여 분화 자극에 반응하기 적절한 상태로 변화하게 된다고 볼 수 있다.
기능적인 차원에서는, naive pluripotency 상태가 분화의 시재료(starting material)로 사용할 수 있는지, 혹은 간단한 priming 작업이 필요한지 아직 분명하지 않다. 이후 naive 상태의 인간 다능성줄기세포가 분화 프로토콜의 시재료로서 기능할 수 있는지, 지금까지 통상적으로 사용된 인간 다능성줄기세포가 성공하지 못했던 분화를 가능하게 할 지 확인해 볼 수 있을 것이다. 고무적이게도, NHSM condition에서 배양된 인간 다능성줄기세포는 통상적 primed 다능성줄기세포와는 달리 원시 생식 세포로 성공적으로 분화하는 결과를 보여줬다. 분자적인 수준에서도 naive pluripotency는 primed pluripotency에 비해 후성적 특성이 제거되어 있는 상태이기 때문에 분화 자극에 대해 보다 효율적으로 반응할 수 있는 것으로 보인다.
Naive 다능성줄기세포를 만드는 기술의 개발은 동종 혹은 이종 간 배아 키메라 분석(embryo chimerism assays)을 통해 더 가속화되고 있다. NHSM condition에서 배양된 원숭이 (cynomolgus monkey) 배아줄기세포는 영장류에서 최초로 키메라를 생성하는 배아줄기세포로 검증되었으며, 생쥐의 배아에 주입하였을 때 초기 발생에 참여하는 것이 확인되었다. 또한 추후 인간화 동물 모델(humanized animal models)을 이용하여 보다 발전된 질병 모델링, 이식 가능한 인간 장기의 생성 연구가 가능할 것이다. 그리고 앞서 언급한 단일 세포 기술을 통해 다능성줄기세포의 다양한 특성을 식별하는 것은 줄기세포에 기반한 치료법의 시재료로서의 가장 적절한 다능성줄기세포 조건을 확립하는데 기여할 것이다. 마지막으로 복잡한 다능성에 대한 보다 깊은 이해는 과학자들로 하여금 세포 운명을 보다 잘 조절할 수 있게 할 것이다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 pdf_0002874.pdf
pdf_0002874.pdf