부처연구성과
활성산소로 인한 염증 조절 메커니즘 규명
- 등록일2014-01-16
- 조회수7837
-
성과명
활성산소로 인한 염증 조절 메커니즘 규명
-
연구자명
김명희
-
연구기관
한국생명공학연구원
-
사업명
미래부 글로벌프론티어 의약바이오컨버젼스연구단과 한국생명공학연구원 전문연구사업 지원
-
지원기관
미래부, 한국생명공학연구원
-
보도자료발간일
2014-01-16
- 원문링크
-
키워드
#활성산소 #염증 조절 메커니즘
- 첨부파일
핵심내용
- 고해상도 입체구조 분석을 통한 염증 조절 단백질 결합체 밝혀내 -
□ 국내 연구팀에 의해 암, 당뇨 등의 염증성 질환이 활성산소에 의해 유발되는 분자적 메커니즘이 밝혀졌다.
□ 한국생명공학연구원(생명硏, 원장 오태광) 생체방어시스템연구센터 김명희 박사팀은 세포의 산화적 스트레스 환경에서 급격히 증가하는 활성산소가 어떠한 요인‧과정에 따라 암, 당뇨와 같은 염증성 질환을 유발하는지에 대한 메커니즘을 규명하였다.
◦ 이번 연구결과는 미래부 글로벌프론티어 의약바이오컨버젼스연구단(단장 김성훈)과 한국생명공학연구원 전문연구사업 등의 지원으로 수행되었고, 세계적 학술지 Nature Communicationsʼ(IF 10.015)에 1월 6일자 온라인판으로 게재되었다
* 논문명 : The structural basis for the negative regulation of thioredoxin by thioredoxin-interacting protein
□ 활성산소(ROS, reactive oxygen species)는 인간의 정상 세포의 활동에서 생성되는 것으로, 세포내에 적당한 농도로 존재하면 세포증식과 분화 등을 조절하는 기능이 있으나, 적외선, 바이러스 감염, 고혈당 등의 환경에서 세포의 스트레스에 의해 과다하게 증가하게 되면 암, 당뇨와 같은 염증성 질환의 원인으로 작용하는 것으로 알려져 있다.
◦ 그러나, 어떤 메커니즘에 의해 활성산소가 염증 조절 등에 영향을 미치는가에 대한 정확한 연구 결과는 알려져 있지 않았다.
□ 연구팀은 염증 조절 단백질 TXNIP와 항산화효소 단백질 TRX의 결합체에 대한 고해상도 입체구조 분석을 통해 활성산소에 의한 두 단백질간 상호작용 조절 메커니즘을 밝히고, 이로부터 활성산소로 인한 염증 조절 원리를 규명하였다.
□ 연구팀은 정상적인 세포 환경에서는 TXNIP(thioredoxin-interacting protein)가 TRX(thioredoxin)의 기능을 억제하기 위해 TRX와 함께 결합체를 형성하고 있다가, 세포의 산화적 스트레스 환경에서 활성산소의 농도가 급격히 증가하게 되면 TXNIP‧TRX결합체에서 TXNIP가 분리된다는 사실을 확인하였다.
◦ 즉, 고농도의 활성산소는 TRX와 TXNIP의 결합체에 직접적으로 영향을 미쳐 TXNIP를 결합체로부터 분리시키고, 분리된 TXNIP는 기존에 발표된 연구*와 같이 가장 중요한 염증조절인자로 알려진 IL-1β(intereukin-1β, 인터루킨-1베타)의 분비를 촉진시켜 염증성 질
환에 영향을 미친다는 사실을 확인할 수 있었다.
* TXNIP가 IL-1β에 영향을 줌으로써 염증성 질환에 관여한다는 사실은 기존에 발표되었던 내용임(ʼ09, 생명硏 최인표 박사)
◦ 또한, 연구팀은 활성산소 농도가 정상적인 세포 환경으로 돌아가면 다시 결합체를 형성한다는 사실을 확인하였는데, 이는 활성산소 농도에 의해 세포의 산화 및 환원 환경이 조성되고 이에 따라 TXNIP와 TRX 두 단백질간에 다양한 종류의 이황화결합이 이루어진다는 것을 알 수 있었다.
* 이황화결합 : 화학결합의 일종으로 분자간 또는 분자내 황원소간의 결합
□ 이번 연구성과는 비정상적인 활성산소의 증가로 인해 유발ㆍ촉진되는 당뇨, 암 등의 염증성 질환 치료를 위한 새로운 이론적 근거를 마련했다는데 의의가 있으며,
◦ 이번 연구를 주도한 김명희 박사는 “TXNIP‧TRX결합체의 고해상도 입체구조는 염증‧당뇨 질환 치료제 개발을 위한 연구기반이 될 것이며, 항암치료제 개발을 위한 중요 타깃으로 연구되고 있는 TRX의 기능 억제 물질 개발에 핵심적 역할을 할 수 있을 것으로 기대한다”고 밝혔다.
상세내용
용 어 설 명
1. 활성산소(reactive oxygen species, ROS)
o 활성산소는 산소원자를 포함한 화학적으로 반응성 있는 분자로 정상적인 대사 작용에 의해서 자연스럽게 생기고 세포신호와 항상성에 중요한 역할을 함.
o 그러나, 자외선 노출, 감염 등의 환경적인 스트레스로 인해 활성산소의 농도는 극적으로 증가 할 수 있고 이를 통한 세포의 산화적 스트레스는 세포 손상을 주고 염증, 암, 당뇨 등의 질환으로 연계가 될 수 있음.
2. TXNIP(thioredoxin-interacting protein)
o 티오리독신 (thioredoxin, TRX) 항산화효소와 상호작용을 통해 TRX의 기능 조절 및 효소 활성 저해를 하는 단백질. 이 외에도 세포내 여러 단백질들과의 상호작용을 통해 다양한 세포 신호 전달 체계에 관여하여 기능을 하고 있는 것으로 보고되고 있다. 암 및 당뇨병 같은 대사성 질환에 밀접하여 관련되어 있음.
3. TRX(thioredoxin)
o 모든 생물에 존재하는 생명에 필수적인 항산화효소로 세포 항산화 기능 뿐 만 아니라 활성산소에 반응하여 다양한 세포 신호 전달에 관여함.
o 최근 연구에서는 대부분의 암세포에서 TRX가 과발현되는 것으로 보고되고 있음.
4. 인터루킨 1베타(interleukin 1β, IL-1β)
o 활성화된 단핵식균세포, 상피세포(epithelial cells), 혈관내피세포(endothelial cell) 등에 의해 만들어지는 염증을 유발시키는 사이토카인(cytokine).
o 적은 양에서는 CD4 T cell과 B cell의 활성화하며 염증세포를 자극할 수 있으나, 그러나 과량 만들어지면 호르몬으로 작용하여 발열, 급성기 반응(acute phases response)등이 나타남.
사 진 설 명

그림 1. TXNIP와 TRX결합체의 고해상도 입체구조
TXNIP와 TRX의 상호작용은 각 단백질이 가지고 있는 TRX 시스테인32번 (C32)과 TXNIP 시스테인247번 (C247) 아미노산 잔기간의 이황화결합 (disulfide bond)에 의해 이루어짐.


그림 2. TXNIP와 TRX의 상호작용은 세포의 활성산소 농도 의존적으로 조절됨.
산화물질인 H2O2 (a)와 diamide (b)를 처리하여 활성산소의 농도를 증가시켰을 시 TXNIP와 TRX가 분리됨. (c) TRX의 시스테인 35번(C35)이 돌연변이 되었을 시 고농도의 활성산소 환경에서도 TXNIP와 TRX 결합체가 분리되지 않음.
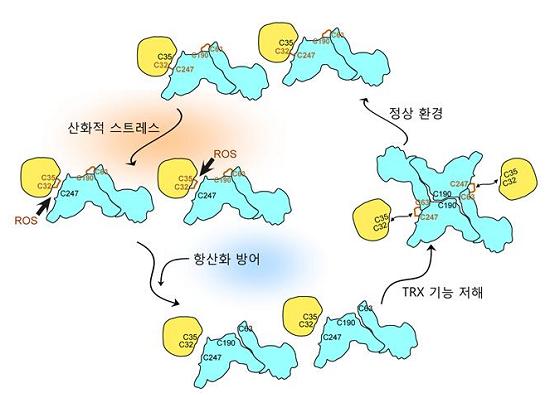
그림 3. TXNIP와 TRX는 각 단백질이 가지고 있는 여러 시스테인 잔기들에 의한 다양한 종류의 이황화결합 스위칭에 의해 상호작용이 조절됨.
TXNIP와 TRX 결합체의 고해상도 입체구조 기반 생화학적 연구를 통해, 정상적인 세포 환경에서 TXNIP와 TRX는 각단백질이 가지고 있는 시스테인 잔기간의 이황화결합을 통해 상호작용하고 있고, 세포의 산화적 스트레스 환경에서 활성 산소의 농도가 급격히 증가하게 되면 두 단백질은 서로 분리가 되어 TXNIP는 염증조절결합체를 활성화하기 위해 기능을 하고, 반면 TRX는 세포를 환원상태로 복구하기 위해 항산화효소로서 기능을 함, 그 후 세포가 정상적인 환경으로 회복이 되면 TXNIP와 TXNIP 분자들간의 이황화결합을 거쳐 다시 TRX와의 이황화결합 결합을 통해서 TRX의 항산화효소 활성을 억제함.
관련정보


 활성산소로+인한+염증+조절+메커니즘+규명.hwp
활성산소로+인한+염증+조절+메커니즘+규명.hwp