부처연구성과
알츠하이머병 유전요인 대거 규명으로 정밀 맞춤치료 기반 마련
- 등록일2025-11-11
- 조회수95
- 분류 생명 > 생명과학, 생명 > 보건의료학, 생명 > 생물공학, 레드바이오 > 의약기술, 레드바이오 > 의약기술, 레드바이오 > 의약기술, 레드바이오 > 의약기술, 제품 > 바이오의약
-
성과명
알츠하이머병 유전요인 대거 규명으로 정밀 맞춤치료 기반 마련
-
저널명
Nature Communications
-
IF
15.7 (2024년 기준)
- 저널링크
-
연구자명
서상원,원홍희,김준표 ,정상혁,안준용,조민영,김찬희
-
연구기관
삼성서울병원, 성균관대학교, 삼성서울병원 , 펜실베이니아 대학교, 고려대학교
-
사업명
삼성서울병원 미래의학 2030사업, 데이터기반 디지털 바이오 선도사업, 바이오의료기술개발, 집단연구지원, 개인기초연구, 치매극복연구개발사업, 만성병관리기술개발연구, 정보통신방송혁신인재양성, 바이오.의료기술개발
-
지원기관
삼성서울병원, 성균관대학교, 과학기술정보통신부, 한국과학기술원, 보건복지부, 질병관리청, 한국국립보건원, 정보통신기술기획평가원, 고려대학교
-
보도자료발간일
2025-11-05
- 원문링크
-
키워드
#알츠하이머 #맞춤치료 #코호트
- 첨부파일
핵심내용
알츠하이머병 유전요인 대거 규명으로 정밀 맞춤치료 기반 마련
- 한국인 코호트 기반 유전체·뇌영상 통합 분석으로 새로운 발병인자 규명-
- SORL1 등 핵심 유전자의 보호 효과 입증, 누적 위험 예측 모델 제시-
- 연구 결과, 국제학술지 네이처 커뮤니케이션즈에 2편 연속 게재-
질병관리청(청장 임승관) 국립보건연구원(원장 직무대리 김원호)은 ‘뇌질환 연구기반 조성 연구사업(BRIDGE)*’을 통해 한국인 노인성 치매환자 코호트**를 기반으로 한국인 치매 환자들의 유전정보와 뇌영상 자료를 분석한 결과, 알츠하이머병 발병에 관여하는 새로운 유전적 요인(SORL1, APCDD1, DRC7 등)을 대거 규명하였다. 또한 여러 유전 요인이 함께 작용해 병이 생기는 ‘누적 효과(cumulative effects) 모델’을 제시하였다.
* 뇌질환 연구기반 조성 연구사업 (Brain disease Research Infrasturcture for Data Gathering and Exploration, BRIDGE) : 뇌질환의 정확한 진단·예방·치료를 위해 흩어져 있는 연구 자원을 한데 모으고, 연구자들이 쉽게 활용할 수 있도록 돕는 사업
** 노인성 치매환자 코호트 (BRIDGE-LLOD): 정상인, 경도인지장애, 치매환자를 장기간 추적해 자료를 수집하는 연구. ’21-’23년 1단계 사업을 시작으로, ’24-’26년 2단계 진행 중 (연구책임자 : 서상원 교수, 삼성서울병원 신경과)
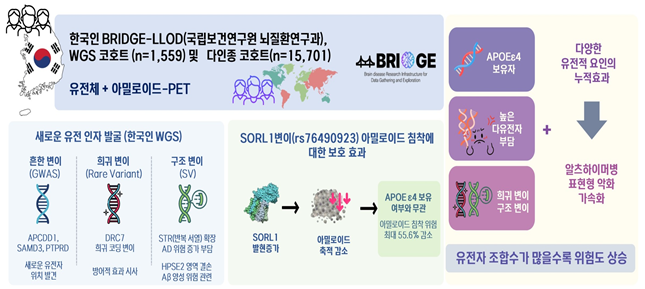
연구진은 한국인 치매 환자들의 전장 유전체(사람의 모든 유전 정보), 아밀로이드 PET 뇌영상 자료를 함께 분석했다. 그 결과, 알츠하이머병의 핵심 원인으로 알려진 베타 아밀로이드 축적과 인지기능 저하를 직접 연관 짓는 유전 인자를 규명함으로써, 질병의 조기 예측과 정밀의학 기반의 치료 표적 발굴에 새로운 근거를 제시했다.
본 연구 결과는 국제학술지 네이처 자매지인 네이처 커뮤니케이션즈(IF 15.7)에 최근 두 편이 연속으로 게재되었으며, 한국인 코호트를 활용한 알츠하이머병 예방·치료 기술 개발을 위한 세계적 수준의 유전체 연구 성과로 평가받고 있다.
알츠하이머병은 전 세계적으로 5천7백만 명 이상이 고통받는 대표적 신경퇴행성 질환으로, 유전적 요인이 전체 발병 위험의 약 60~80%를 차지하는 것으로 알려져 있다. 그러나 지금까지의 대규모 유전체연관분석(GWAS)*은 대부분 유럽인 중심으로 수행되어, 아시아 인구의 유전적 다양성과 특이적 변이를 충분히 반영하지 못했다.
* GWAS 유전체연관분석 : 유전체 전반의 유전 변이를 비교해 질환과 관련된 유전자를 찾아내는 분석 기법
또한 대부분의 유전체연관분석이 임상 진단만을 기준으로 수행되어, 실제 병리적 아밀로이드 축적 여부를 반영하지 못한다는 한계가 있었다.
이에 연구진은 한국인 대상 정밀 영상·유전체 통합 연구 플랫폼을 활용하여 뇌영상에서 확인된 베타 아밀로이드 축적 정보와 전장 유전체 데이터를 함께 분석했다. 이 과정에서 SORL1 유전자*가 베타 아밀로이드 축적을 억제하는 핵심 인자임을 밝혀냈다.(붙임2 참조)
* SORL 1(Sortilin-Related Receptor 1) : 아밀로이드 전구체 단백질(APP)의 세포 내 수송과 분해를 조절하는 유전자로, 기능이 저하 될 경우 아밀로이드 축적이 증가하여 알츠하이머병 위험이 높아지는 것으로 알려짐.
특히 여러 유전변이가 동시에 존재할 경우 위험이 누적되어 알츠하이머병 발병률이 급격히 증가하는 현상을 확인, 이를 설명하는 ‘누적 효과(cumulative effects) 모델’을 제시했다. 이 모델은 개인의 유전적 조합에 따른 발병 예측과 맞춤형 치료전략 수립에 중요한 단서를 제공할 것으로 기대된다.(붙임3 참조)
연구를 주도한 서상원 교수 및 공동연구진*은 “임상 진단 중심의 기존 연구에서 벗어나, 병리적 바이오마커(PET)와 유전체 정보를 결합해 알츠하이머병의 생물학적 기전을 직접 확인했다는 점에서 큰 의미가 있다”고 밝히며, “이번 연구가 정밀한 위험 예측과 맞춤 치료의 기반이 될 것”이라고 강조했다.
* (성균관대학교) 원홍희, 조민영, 정상혁, 김준표, (고려대학교) 안준용, 김찬희
임승관 질병관리청장은 “이번 성과는 국가주도로 구축한 코호트와 데이터 인프라가 중요함을 입증한 사례”라고 전하며, “질병관리청은 앞으로도 국가 단위의 코호트 장기 추적조사 연구를 계속 지원해 나가고, 더불어 유전체·임상·영상 정보를 통합한 연구를 적극 지원해, 치매를 비롯한 주요 만성질환의 조기 예측과 맞춤형 치료가 가능한 기반을 마련하겠다”고 말했다.
상세내용
붙임1 치매 현황
1. 치매 개요
○ 치매는 정상 생활을 하던 사람이 다양한 원인으로 뇌가 손상되어 이전보다 인지 및 고도 정신기능이 떨어져 일상생활이 어려운 상태를 말한다.
○ 치매는 연령이 증가하면서 발생이 증가하므로, 노인인구가 증가하는 우리나라의 앞으로 큰 보건의료 문제가 될 것으로 예상된다.
2. 치매 유병률
○ 우리나라 65세 이상 노인인구 중 추정 치매환자는 2023년 약 87만 명(추정 치매 유병률 9.17%)이다. <표1>
○ 남성보다는 여성 환자가 많으며, 연령은 85세 이상, 80-84세, 75-79세, 65-69세, 70-74세 순으로 많게 나타났다.
○ 중증도*별로는 경도 치매 환자 비율이 전체 추정 치매 환자의 절반이 넘는다 (약 67.7%).
*치매임상평가척도(CDR : Clinical Dementia Rating)와 퇴화척도(GDS)를 적용하여 치매 중증도 분류
CDR이 0.5, 1 또는 GDS 2, 3, 4는 경도 치매, CDR이 2 또는 GDS가 5, 6은 중등도 치매, CDR 3, 4, 5 또는 GDS 7은 중증 치매로 분류
3. 치매 사망률
○ 2023년 치매로 사망한 사람은 총 14,251명으로 전년 대비 0.8% 증가하였고, 치매 사망률(인구 10만 명당 명)은 27.9명으로 전년 대비 0.3명 증가하였다. <표2>
- 남성보다 여성에서, 그리고 연령이 높을수록 치매 사망률이 더 높았다
4. 치매 관리비용
○ 치매환자 1인당 연간 관리비용은 약 2,639만 원으로 나타나며, 의료비와 약제비로 구성된 직접의료비의 비율이 42.3%로 가장 많이 차지하고 있다. <표3>
○ 치매환자 1인당 연간 진료비는 약 286만원이다. <표4>
<표1> 치매 65세 이상 추정환자수(2023)
|
| 추정 환자수(명) | 구성비(%) |
| 867,802.8 | 100.0 | |
성별 | 남성 | 357,418.2 | 41.2 |
여성 | 510,384.6 | 58.8 | |
연령구간(세) | 65-69 | 139,836.1 | 16.1 |
70-74 | 112,065.3 | 12.9 | |
75-79 | 179,721.3 | 20.7 | |
80-84 | 205,879.3 | 23.7 | |
85+ | 230,300.8 | 26.6 | |
중증도별 | 경도 | 587,502.5 | 67.7 |
중등도 | 256,001.8 | 29.5 | |
중증 | 24,298.5 | 2.8 | |
[자료출처]중앙치매센터, 대한민국 치매현황 2024
<표2> 성별 및 유형별 치매 사망률 (2022-2023)
(단위 : 인구 10만 명당 명, %)
구분 | 연도 | 사망자수 | 사망률 | |||
전체 | 알츠하이머 치매 | 혈관성 치매 | 상세불명의 치매 | |||
전체 | 2022 | 14,136 | 27.6 | 22.7 | 0.8 | 4.1 |
2023 | 14,251 | 27.9 | 21.7 | 0.7 | 5.4 | |
남성 | 2022 | 4,361 | 17.1 | 13.5 | 0.7 | 2.9 |
2023 | 4,576 | 18.0 | 13.7 | 0.5 | 3.8 | |
여성 | 2022 | 9,775 | 38.0 | 31.8 | 0.9 | 5.3 |
2023 | 9,675 | 37.7 | 29.7 | 0.9 | 7.1 | |
[자료출처]중앙치매센터, 대한민국 치매현황 2024
<표3>치매환자 1인당 연간 관리비용(2023)
(단위 : 원, %)
비용구성 | 설명 | 관리비용 | 구성비 |
전체 |
| 26,389,065 | 100.0 |
직접의료비 | 치매 치료를 위한 비용 (의료비, 약제비로 구성) | 11,154,630 | 42.3 |
직접비의료비 | 간병비, 병원이용 교통비, 보조물품 구입비와 환자 및 조호자가 의료기관을 방문함으로써 발생하는 시간 비용 포함 | 3,312,828 | 12.6 |
노인장기요양비용 | 장기요양비용 | 11,037,714 | 41.8 |
간접비 | 조기 퇴직 등 치매로 인해 환자에게 발생하는 생산성 손실비용 | 883,893 | 3.3 |
[자료출처]중앙치매센터, 대한민국 치매현황 2024
<표4>치매환자 1인당 연간 진료비(2023)
(단위 : 명, 원)
전체 치매상병자 | 전체 진료비 | 1인당 진료비 |
1,030,524 | 2,944,661,824,020 | 2,857,441 |
[자료출처]중앙치매센터, 대한민국 치매현황 2024
붙임2 연구결과[논문] 요약 1
□ 게재학술지 : Nature Communications (2025)16:3150
□ 논문제목
(국문) 다인종 유전체 연관 연구를 통한 뇌 베타-아밀로이드 침착 관련 SORL1유전자 변이의 규명
(영문)Cross-ancestry genome-wide association study identifies implications of SORL1 in cerebral beta-amyloid deposition
□ 연구목적
본 연구는 알츠하이머병의 핵심 병리 지표인 뇌 내 베타-아밀로이드(β-amyloid, Aβ) 침착과 관련된 새로운 유전적 요인을 규명하기 위해 수행되었음. 특히, 기존 유럽인 중심의 임상 진단 기반 GWAS에서 벗어나 동아시아와 유럽인을 포함한 다인종 집단(cross-ancestry) 을 대상으로, PET 영상 기반의 Aβ 정량 지표를 이용한 GWAS 및 통합 메타분석을 통해 SORL1의 병태생리학적 역할을 규명하는 것이 목적임.
□ 연구 배경
알츠하이머병은 유전적 요인이 60–80%에 달하는 복잡한 신경퇴행성 질환으로, 지금까지의 대규모 GWAS에서 70개 이상의 유전자 좌위가 확인되었지만 이는 진단적 표현형의 약 15%만을 설명함. 대부분의 연구가 유럽인(European ancestry) 을 대상으로 하고, 임상 진단 혹은 가족력 기반 AD 정의를 사용하여, 실제 병리 생물학적 기전과의 불일치 및 인종 다양성의 부족이 한계로 지적되고 있음.
최근에는 임상 진단 대신 바이오마커 기반 진단 체계로 전환되면서, PET 기반 아밀로이드 영상이 가장 신뢰도 높은 핵심 바이오마커로 인정되고 있음. 이에 따라, 다양한 인종 집단을 포함한 생물학적 지표기반 GWAS를 통해 새로운 병인 관련 유전자 변이를 찾을 필요성이 제기됨.
□ 연구 방법
○ 연구대상 및 데이터
한국형 치매 환자 코호트(2017–2023)의 3,387명 동아시아(EAS) 참가자 데이터를 이용하여 1단계 GWAS를 수행함. 영상 기반 아밀로이드 축적 정도를 정량화하고, 마이크로 어레이 및 전장유전체 시퀀싱(WGS) 데이터를 포함한 5,110,277개 변이를 분석함. 2단계로 2023–2024년 추가 모집된 753명의 독립표본을 이용해 SORL1 및 ECRG4 지역의 변이 복제 분석을 시행함.
○ 통합분석
기존 유럽인(EUR) GWAS 데이터(11,816명, Ali et al.)와의 cross-ancestry 메타분석을 수행(METAL 프로그램 이용) 총 15,701명의 참가자, 6,648,274개 변이를 분석하여 유전자 좌위 간 공통 및 인종별 차이를 평가
○ 기능적 검증
ROSMAP 코호트의 단일핵 RNA 시퀀싱(snRNA-seq) 데이터를 통해 SORL1의 미세아교세포(microglia) 특이 발현을 확인, 아밀로이드 병리 양성 여부에 따른 SORL1 발현 차이를 추가 분석
□ 연구 결과
- 동아시아인 GWAS(1단계) 에서 3개의 유의 유전자 좌위가 확인됨. APOE, SORL1(rs76490923), ECRG4. 이 중 SORL1 변이(rs76490923)는 새로운 아밀로이드 침착 관련 변이로 확인됨
- 복제 분석(2단계)에서 SORL1 변이가 독립 집단에서도 동일한 효과로 재현(p = 6.67×10⁻³)되었으며, ECRG4 변이는 재현되지 않음.
- 인종 간 비교 결과, SORL1 변이는 유럽인에서도 동일한 방향의 효과를 보였고, 동아시아 집단에서 더 높은 대립유전자 빈도(MAF=0.21)를 나타냄.
- 다인종 통합 메타분석에서 APOE, CR1, FERMT2, SORL1 등 4개 유전자가 유의하게 연관됨(p<5×10⁻⁸). 특히 SORL1(rs76490923)은 통합 분석에서 가장 높은 통계적 유의성(p=3.09×10⁻¹¹) 을 보임.
- 기능분석에서는 SORL1이 β-amyloid 양성 미세아교세포에서 차등 발현됨이 확인되었고, APOE4 보유자에서도 SORL1 변이가 존재할 경우 Aβ 침착 위험이 43~56% 감소하는 보호 효과(protective effect)가 관찰됨.
□ 결론
본 연구는 동아시아와 유럽인을 아우르는 다인종 아밀로이드 PET 기반 GWAS 메타분석으로, 기존 알려진 APOE, CR1, FERMT2 외에 SORL1 유전자 변이(rs76490923) 가 β-amyloid 침착에 유의하게 관련됨을 새롭게 규명함. 또한, SORL1이 미세아교세포에서 병리적 발현 조절을 통해 병인에 기여할 수 있음을 제시하였으며, 이는 향후 SORL1을 표적하는 치료 전략 및 조기 바이오마커 개발의 핵심 단서가 될 것으로 기대됨.
![붙임2 연구결과[논문] 요약 1](/InnoDS/data/upload/report/34bb5723-dc9a-435d-afbf-4f3522b97684.png)
붙임3 연구결과[논문] 요약 2
□ 게재학술지 : Nature Communications (2025)16:4870
□ 논문제목
(국문) 전장유전체 염기서열 분석을 통한 알츠하이머병 관련 새로운 유전 요인 규명 및 누적 효과 모델 제시
(영문) Whole-genome sequencing analyses suggest novel genetic factors associated with Alzheimer’s disease and a cumulative effects model for risk liability
□ 연구목적
본 연구는 한국인 알츠하이머병(Alzheimer’s disease, AD) 코호트에서 전장유전체 염기서열 분석(Whole-Genome Sequencing, WGS) 을 수행하여, 기존 GWAS에서 규명되지 못한 희귀 변이(rare variants) 및 구조적 변이(structural variants) 를 포함한 새로운 유전적 요인을 탐색하고, 이들 변이가 인지기능 저하 및 아밀로이드 병리(Aβ 침착) 에 미치는 누적 위험 효과(cumulative risk model) 를 규명하는 것을 목표로 함.
□ 연구배경
알츠하이머병은 전 세계적으로 약 5,700만 명 이상이 고통받는 대표적인 신경퇴행성 질환으로, 유전적 요인이 60~80%에 달함. 지금까지 대규모 GWAS에서 75개의 AD 관련 유전자 좌위가 보고되었으나, 이는 진단적 표현형의 약 15%만을 설명하며, 특히 유럽인(European ancestry) 에 편중된 연구가 대부분임.
이에 따라 인종적 다양성 확보 및 비부호화 영역(non-coding regions)과 구조적 변이(SV, CNV, STR) 등 기존 연구에서 충분히 탐구되지 않은 유전 요인의 통합적 규명이 필요함.
또한, 기존의 임상 진단 기반 AD 정의는 실제 병리와 불일치할 수 있으므로, 바이오마커(예: PET 기반 아밀로이드 침착)를 활용한 연구가 보다 정밀한 유전 신호 탐색에 필수적임.
□ 연구방법
○ 연구대상 : 한국인 알츠하이머병 코호트 1,559명(WGS 고심도 데이터). 임상 진단, 인지기능 지표, 그리고 아밀로이드 PET 영상 데이터를 통합 분석
○ 유전체 분석 : 전장유전체 염기서열(WGS)을 이용하여 공통 변이 (common variants) 및 희귀 변이(rare variants)를 모두 탐색
○ 통합위험 분석 : APOE ε4 보유자와 비보유자에서 다유전자 위험 점수(polygenic burden) 및 구조적 변이가 인지기능 저하 및 Aβ 침착에 미치는 누적 영향을 모델링
□ 연구결과
○ 공통 변이 분석(GWAS): AD와 유의하게 연관된 새로운 공통 변이 좌위 APCDD1 확인. 본 변이는 기존 GWAS에서 보고되지 않은 신규 유전 신호로 제시됨.
○ 희귀 변이 분석: 흥분성 신경세포(excitatory neurons) 특이적 조절 요소 내의 희귀 비부호화 변이가 인지기능 저하(cognitive impairment) 와 유의하게 연관됨을 확인.
○ 구조적 변이 분석: 짧은 반복서열 확장(STR expansion) 은 AD 위험 증가와 관련됨. HPSE2 유전자 영역의 복제수 변이(CNV)는 통계적으로 경계선 수준의 유의성(p≈0.05)에 도달.
○ 누적 효과 모델(cumulative effects model): APOE ε4 보유자 중 다유전자 부담(polygenic burden)이 높거나 구조적 변이를 가진 경우, 인지기능 저하가 더 심하고, 아밀로이드 베타(Aβ) 수치가 유의하게 증가함이 관찰됨. 이는 다양한 유전 요인들이 상호작용하여 생리에 누적적으로 기여함을 의미함.
□ 결론
본 연구는 한국인 기반 전장유전체 분석을 통해 알츠하이머병의 새로운 유전 요인(APCDD1, 희귀 조절 변이, 구조적 변이 등)을 규명하였으며, APOE ε4, 다유전자 부담, 구조적 변이의 상호 누적 효과 모델을 제시함. 이는 기존 유럽 중심 GWAS가 포착하지 못한 아시아 특이적 유전 구조와 병리 기전을 밝혀낸 것으로, 향후 정밀의학 기반 AD 위험 예측 및 맞춤형 치료 표적 개발에 중요한 기초 자료가 될 것으로 기대됨.
![붙임3 연구결과[논문] 요약 2](/InnoDS/data/upload/report/2a239c4f-e86b-467c-8688-baed86a99855.png)
붙임4 뇌질환연구기반조성연구(BRIDGE) 및 노인성치매환자 코호트
□ 뇌질환 연구기반 조성 연구사업
(Brain disease Research
Infrastructure for Data Gathering and Exploration : BRIDGE)
질병관리청 국립보건연구원이 중심이 되어 국내 여러 대학 및 의료기관과 협력하여 수행하는 국가 연구사업으로, 향후 뇌질환의 정확한 진단법, 예측모형개발, 예방·관리 지침 개발 등을 위한 연구 성과가 극대화될 수 있도록 뇌질환 코호트를 중심으로 산재된 인프라를 통합하고, 연계하여 제공하는 기반을 구축하는 사업
- 데이터 간 연계가 가능하도록 뇌질환 코호트 공통항목 설정 등 표준화및 단계별 정제를 통한 질 관리로 고품질의 임상데이터를 확보하고 있음. 또한, 뇌영상, 유전체 표준화 데이터 생산을 통해 임상정보와 연계 가능한 인프라의 범위를 확장함.

[BRIDGE 리플렛]
□ 병원기반 노인성 치매환자 추적조사연구(노인성 치매환자 코호트)
○ 연구목표 : 병원기반의 노인성 치매 코호트 구축 및 추적조사를 통한 임상정보 및 연구자원 확보, 노인성 치매환자의 질환 특성을 이해하고 예방 및 예후관리 근거 마련
○ 주관연구기관 : 삼성서울병원 (연구책임자 : 서상원 교수)
○ 참여병원 : 삼성서울병원 등 전국 18개 병원(’25년 기준)
○ 연구기간 : 1단계 :2021.4.9.~2023.12.31./2단계 : 2024.4.17.~진행중
○ 연구대상자 : 65세 이상에서 발병한 알츠하이머병 치매, 피질하혈관성 치매, 루이체치매 및 경도인지장애 환자, 주관적 인지기능장애
○ 수집항목 : 임상·역학정보, 신경심리검사, 혈액검사, 뇌영상검사(MRI, 아밀로이드-PET), 전장유전체분석(Whole Genome Sequencing, WGS), 인체자원(혈장, 혈청, DNA, PBMC) 등
○ 연구내용
- 병원기반 노인성 치매환자 코호트 구축 (1단계 3년간 총 646명 모집)
· 추적조사 : 1년마다 임상검사, 3년마다 혈액검사, 영상검사 실시
· 2단계 기반구축 : 매년 신규 100명 코호트 대상자 모집
- 조기진단, 감별진단, 예후 예측 및 전주기진행경과 예측 모델 개발
- 치매환자 질환관리기술개발·검증연구 등 코호트 자료를 활용한 질환관리 연구

...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
다음글
- 다음글이 없습니다.
-
이전글
- 미세먼지 노출로 인한 면역세포 내 염증·지질대사 교란을 실시간으로 규명하다
지식


 20251105_IF 15.7_알츠하이머병 유전요인 대거 규명으로 정밀 맞...
20251105_IF 15.7_알츠하이머병 유전요인 대거 규명으로 정밀 맞...