산업동향
면역세포치료제 상용화 동향
- 등록일2021-07-23
- 조회수5831
- 분류산업동향 > 제품 > 바이오의약
-
자료발간일
2021-07-18
-
출처
한국바이오협회
- 원문링크
-
키워드
#한국바이오협회#면역세포치료제
- 첨부파일
면역세포치료제 상용화 동향
◈목차
1.면역세포치료제의 개념
2.면역세포치료제의 상용화 현황
3.면역세포치료제의 주요 개발 동향
4.면역세포치료제의 상용화 이슈
◈본문
최근 면역세포치료제(immune cell therapy)의 상용화가 가속화되고 있다. 특히 후천성 면역 세포인 T 세포를 활용한 키메라 항원 수용체 T 세포 치료제(Chimeric Antigen ReceptorT cells therapy, 이하 CAR-T 치료제) 시장이 빠르게 확대되고 있다.
미국 식품의약국(이하미 FDA)은 2017년 8월 세계 최초 CAR-T 치료제인 Novartis의 급성림프구성백혈병(acutelymphoblastic leukaemia, ALL) 치료제 킴리아(Kymriah, 성분명 tisagenlecleucel)를 시작으로 동해 10월 Gilead의 미만성거대B세포림프종(diffuse large B-cell lymphoma, DLBCL)치료제 예스카타(Yescarta, 성분명 axicabtagene ciloleucel)1)와 2020년 Gilead의 외투세포림프종(mantle cell lymphoma, MCL) 치료제 테카투스(Tecartus, 성분명 brexucabtagene autoleucel)를 승인한 바 있으며, 올해 2월과 3월 각각 Bristol Myers Squibb(이하 BMS) 의 미만성거대B세포림프종(DLBCL) 치료제 브레얀지(Breyanzi, 성분명: lisocabtagenemaraleucel)와 다발성골수종 치료제 아베크마(Abecma, 성분명: idecabtagene vicleucel)를 승인했다.2)
이로써 현재 Novartis가 한 개, Gilead와 BMS는 각각 두 개의 CAR-T 치료제를 보유하고 있다. 면역세포치료제의 국내 시장도 성장이 전망된다. 지난해 9월 '첨단재생의료 및 첨단바이오의 약품 안전 및 지원에 관한 법률'(이하 첨단재생바이오법)이 시행된 이후 올해 5월 세계 최초 CAR-T 치료제인 Novartis의 킴리아가 제1호 첨단바이오의약품으로 식품의약품안전처의 허
가를 획득했다.
올해 4월에는 국내기업 큐로셀이 미만성거대B세포림프종(DLBCL) 치료 후보 물질로 국내 기업 최초로 CAR-T 치료제 임상시험을 시작하면서 국내 최초로 CAR-T 치료제의 투여가 실시됐다.3)
세포치료제는 유전자치료제와 함께 이른바 3세대로 분류되는 바이오의약품으로 1세대인 재조합 단백질 의약품과 2세대인 항체 의약품과 전혀 다른 기술 기반을 요구하고 있어 그동안상용화가 빠르지 않았다. 하지만 면역세포치료제가 암이나 자가면역질환과 같은 난치성 질병분야에서 치료 효과를 보이면서 상용화가 가속화되고 있다.
특히 최초의 CAR-T 치료제인 킴리아의 핵심적인 임상연구에서 83%의 암환자가 완전관해(complete remission)를 보이는
등 혁신적인 효능이 입증됨에 따라 최근 3세대 바이오의약품의 연구개발과 상용화 노력이 급격히 확대되고 있다.4) 본 리포트는 면역세포치료제의 상용화 동향과 이슈, 바이오의약품 산업에 일어나고 있는 변화를 분석한다.
1. 면역세포치료제의 개념
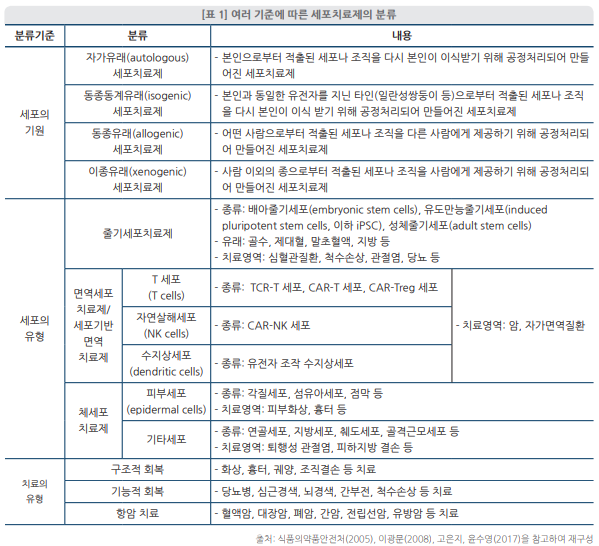
면역세포치료제의 상용화 동향과 이슈를 이해하기 위해서는 먼저 세포치료제의 기본적인 개념과 종류를 이해해야 한다. 2020년 9월 시행된 「첨단재생의료 및 첨단바이오의약품 안전및 지원에 관한 법률」(이하 첨단재생바이오법)에 의하면 세포치료제란 첨단바이오의약품의하나로 “사람 또는 동물의 살아 있는 세포를 체외에서 배양ㆍ증식하거나 선별하는 등 물리적, 화학적 또는 생물학적 방법으로 조작하여 제조한 의약품”이다.5) “다만, 생물학적 특성이유지되는 범위에서 단순분리, 세척, 냉동, 해동 등의 최소한의 조작을 통하여 제조된 것”으로서 “의료기관에서 환자의 수술 또는 시술에 사용하기 위해 해당 환자의 세포로 제조한 의약품”은 제외한다.
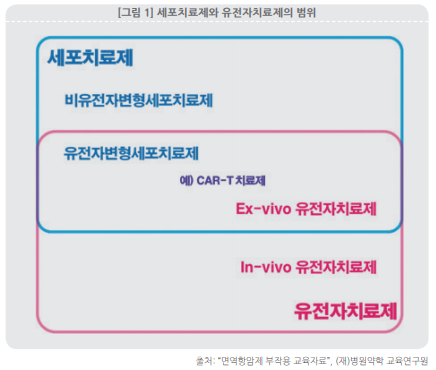
세포치료제는 치료 효과를 내는 세포를 주입한다는 점에서 치료 효과를 내는 유전자를 주입하는 유전자치료제와 구분되지만, 유전자 변형 세포(gene modified cell)를 활용하는 경우처럼 두 치료제의 중간영역도 존재한다. 대표적으로 유전자 변형을 통해 T 세포의 암세포 인지능력을 강화시킨 CAR-T 치료제는 세포 단위에서 치료 효능이 나오지만 체외 유전자 변형(exvivo gene modification)을 통해 치료 효능이 강화되는 경우다.
이 중간영역은 보통 유전자변형세포치료제(gene-modified cell therapy)로서 광의의 세포치료제로 포함되지만 체외유전자치료제(ex-vivo gene therapy) 혹은 세포기반유전자치료제(cell-based gene therapy)로서 유전자치료제에 포함되기도 한다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 [bio economy report] 29호_면역세포치료제 상용화 동향.pdf
[bio economy report] 29호_면역세포치료제 상용화 동향.pdf