제도동향
의약품 안전성정보 보고 처리 절차(민원인 안내서) 개정 알림
- 등록일2021-08-18
- 조회수4999
- 분류제도동향 > 종합 > 종합
-
자료발간일
2021-08-09
-
출처
식품의약품안전처
- 원문링크
-
키워드
# 안전성정보 #의약품 #의약품 안전성정보 보고
- 첨부파일
의약품 안전성정보 보고 처리 절차(민원인 안내서) 개정 알림
◈목차
1. 목적
2. 의약품 안전성정보 보고 개요
3. 보고 자료 및 제출방법
4. 평가 및 처리
5. 허가사항 변경명령 절차
[붙임] 품질 분야 안전성정보 보고 서식
◈본문
1. 목적
의약품 품목허가를 받은 자의 ‘의약품 안전성정보’ 보고방법 • 제출자료 및 식약처의 처리절차를 안내하고자 함
2 의약품 안전성정보 보고 개요
O (개요)의약품 품목허가를 받은 자는 안전성과 관련된 새로운 정보를 발견하거나 추가적인 안전대책이 필요하다고 판단되는 겨웅에는 식약처장에게 보고해야함
* 관련 규정:「의약품 등의 안전에 관한 규칙」[별표 4의3] 제6호라목
O (정보구분) 신속한 보고가 필요한 정보 및 그 외 정보로 구분됨
1. 신속보고 대상 정보
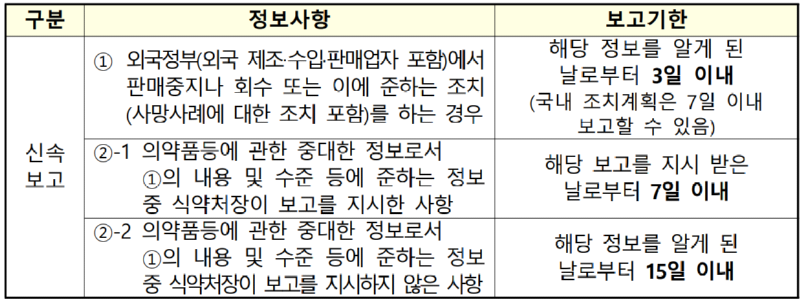
* 관련 규정:「의약품 등의 안전에 관한 규칙」[별표 4의3] 제7호가목
- 해당정보를 처음 알게된 시점에는 신속보고 대상이 아니었으나 추가정보에 의해 신속보고 대상이 된 경우에는 추가 (변경된)정보를 알게된 시점을 'DAY 0 '으로 할수있음
2. 신속보고 대상이 아닌 정보
- 규저에 보고기한이 명시되어 있지 않으나, 해당 정보를 알게된 분기내 보고를 권장
*국외 조치의 근거자료 확보지연등 부득이한 사유로 기한내에 보고할수 없는 경우에는 그 사유와 보고예정일을 명시하여 제출해야함
3. 보고 자료 및 제출방법
o (제출자료) 신속보고 대상 정보 및 그 외 정보로 구분됨
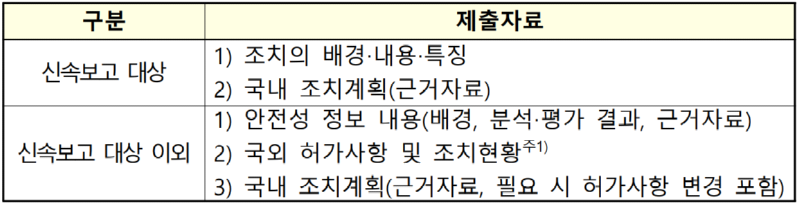
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
지식
동향


 의약품+안전성정보+보고+처리+절차(민원인+안내서).pdf
의약품+안전성정보+보고+처리+절차(민원인+안내서).pdf