산업동향
글로벌 보건산업 동향 Vol.481 - IW, 바이오시밀러 생산의 해외 이전 경고
- 등록일2023-08-11
- 조회수2408
- 분류산업동향 > 제품 > 바이오자원
-
자료발간일
2023-07-31
-
출처
한국보건산업진흥원
- 원문링크
-
키워드
#바이오시밀러#알츠하이머#의약품#임상시험
IW, 바이오시밀러 생산의 해외 이전 경고
글로벌 보건산업 동향 Vol.481
◈ 목차
◈ 포커스
- IW, 바이오시밀러 생산의 해외 이전 경고
◈ 제약·의료기기·화장품
- 알츠하이머 치료제 Leqembi, FDA의 완전 승인 획득
- Intuitive社, 최소침습 기관지 내시경 플랫폼 기반으로 매출 확대 기대
- 영국 캠브리지 대학, 외상성 뇌손상 연구 플랫폼 공동 운영
- 프랑스, 필수 의약품 국내 생산 재개 계획 발표
- 일본 제약회사, 승인받은 신약 가운데 외부 도입품 비중 높아
- 中 과학기술부, ‘인류 유전자원 관리조례 실시세칙’ 발표
- Biopharma Dive, ’23년 하반기 주목해야 할 10대 임상시험 선정
- Dall-E, ChatGPT 등 생성형 AI가 화장품 업계의 혁신 견인
◈ 의료서비스
- 미국, 의료비 사기 및 정크 보험 플랜에 대한 보호 조치 발표
- Cigna Group, ’22년 ESG 보고서 발표
- 미 AEI, 제네릭 의약품 개발 촉진 위한 우선 심사 바우처 프로그램 제안
- 中, 의사-환자 간 소통 효율 제고를 위한 프로젝트 추진
- 中, 의료관광 시장 발전을 위해 해외 의료진 및 의료관광객 적극 유치
- 인도 성형수술 산업, 외국인 의료관광객이 증가 추세
- 중앙 및 서아시아, ADB의 지역 건강 시스템 강화 전략
- Aster DM Healthcare, Dubai Development와 의료시설 건설 계약
◈ 디지털 헬스케어
- ’23년 상반기 디지털 헬스, 자금 조달시장 축소로 힘든 시기 도래
- 원격의료로 직접 방문 형식의 후속방문 횟수 감소
- 영국 바스⼤, 3D 프린팅 인공 무릎 개발
- 유럽 EHDS, 병원 약사들의 작업을 용이하게 할 전망
- 싱가포르, 상처 회복을 모니터링하는 AI 기반 센서 패치 개발
- AI, 의료분야의 디지털 기술이 암 퇴치 가능성 제고
- Brookings, ChatGPT가 미국 헬스케어 시장에 미치는 영향 검토
- 의료분야의 AI, 형평성 관련 문제의 식별과 해결방안 제시
◈본문
IW, 바이오시밀러 생산의 해외 이전 경고
독일 쾰른 경제연구소(IW)는 독일 의약품 시장에서 약 1/3을 차지하는 바이오의약품의 중요성을 조명하며, 바이오시밀러 생산 구조를 분석하고 비용 압박으로 제네릭 생산거점을 아시아로 이전했던 전철을 반복하지 않기 위해서는 비용 절감보다 공급 복원력과 안전성을 우선하는 보건 정책이 필요하다고 제언 |
[1] 개요
•︎ 의약품 공급 병목 현상이 증가함에 따라 공급 보안을 강화하는 것이 시급하며 특히 제약성분 생산기지를 아시아로 이전하는 것은 문제로 진단
•︎ 유럽과 독일은 현재 바이오시밀러 생산의 선두 지역이지만 이 입지가 잠식될 수 있는 징후가 있으므로 복원력을 지향하는 보건 정책은 이 유망한 산업의 잠재적 해외 이전을 방지하는 것이 필요
* 바이오시밀러(biosimilar drug): 오리지널 바이오의약품과 유사한 성분으로 만든 의약품
[2] 바이오시밀러 생산 입지의 중요성
•︎ 바이오의약품은 의약품 공급에서 점점 더 중요해지고 있으며 ’10년 독일 제약 시장에서 17%였던 바이오의약품의 비율은 ’21년에는 이미 31%를 초과
•︎ 특히 바이오시밀러, 즉 특허권이 만료된 바이오의약품의 후속 제약은 향후 혁신적인 제약성분으로 인해 중요성이 점증하고 공급 비중도 증가할 전망
•︎ 바이오시밀러는 일반적으로 오리지널 약제보다 저렴하므로 보건의료의 재정적 지속 가능성에 기여할 수 있으나, 독일 보건 시스템은 주로 바이오시밀러의 비용 절감 잠재력에만 주목하고 있어 바이오의약품 공급망의 복원력과 공급 안전성을 간과할 위험이 존재
- 비용 절감에만 일방적으로 집중하면 바이오의약품의 생산이 생산 비용이 낮은 국가, 특히 아시아로 이전될 수 있으며 그 결과는 제네릭 의약품 공급의 현재 병목 현상이 명백히 시사
* 제네릭 의약품(generic drug): 오리지널 합성의약품과 동일한 성분으로 만든 의약품
•︎ ’06년~’10년 사이 유럽에서 출시된 바이오시밀러의 인가 기업 중 2/3가 유럽에 소재할 정도로 유럽 기업들이 바이오시밀러 시장을 지배하였으나 ’16년 이후 점점 더 많은 국가가 동 시장에 진출하면서 ’16~’20년 사이 유럽의 인가 보유 기업 비율은 30%에 불과한 상황
- ’21년 글로벌 제품 파이프라인, 즉 개발 중인 바이오시밀러의 지역별 분포를 살펴보면, 미래에는 경쟁의 지역적 다양화가 더 강화되고 바이오시밀러 시장에서 아시아 기업들의 비중이 더욱 확대될 전망
❙ 바이오시밀러 공급기업의 소재 지역 분포 ❙

•︎ 유럽의 관점에서 지역 다양화의 방향성과 글로벌 경쟁의 증가는 주의 깊은 관찰이 필요한데 지난 수십 년 동안 서구 보건의료 시장은 특히 제네릭 영역에서 글로벌 경쟁과 가격 압박의 증가로 생산기지 이전과 시장 축소에 이르렀기 때문
[3] 바이오시밀러 제약성분 생산지의 분포 변화
•︎ 제약 성분 생산은 지역적으로 매우 편중된 상황으로 유럽 시장 대상 제약성분의 68%는 아시아에서 오며 그중 중국(24%)과 인도(37%)가 유럽 시장의 가장 큰 공급국이지만, 바이오의약품 시장 하위 부문의 제약성분 생산은 지역적 분포에서 분명한 차이가 존재
- 제네릭 의약품 제조에 필요한 제약 성분 생산은 아시아 시장에서 가장 집중되어 있으며 제약성분 인가(CEP)의 60% 이상을 아시아가 보유하고 있고 1/3은 유럽이 보유
- 오리지널 바이오의약품 제조에 필요한 성분 생산지 분포에는 거의 변화가 없는데 이는 미국과 유럽의 회사가 혁신적이고 기술적으로 복잡한 의약품 및 제약성분의 개발 및 생산에 특화되어 있고 이 분야에서 높은 수준의 전문성을 보유하고 있음을 시사
- 아시아에서는 단순한 제네릭 제품의 생산이 우세하지만, 과거 제네릭 의약품 생산지의 이전을 고려하면 향후 바이오시밀러 부문에서도 유사한 양상이 반복될 위험성은 현존
- 바이오시밀러 제약성분 인가의 지역 분포는 승인된 제약성분의 51%가 유럽에서 생산되고 있어 유럽이 여전히 생산 지역으로서 지배적인 역할을 하고 있음을 확인
•︎ 그러나 인가 보유 기업과 글로벌 제품 파이프라인 모두에서 지역 다변화가 명백해지고 있으며 이는 생산 입지의 변천 결과에 반영
- 바이오시밀러 부문 제약성분 생산에서 15%를 차지하는 한국 외에도 중국과 인도가 지난 10년간 동 부문 제약성분의 생산지로서 가장 큰 성장을 기록(’13년 5%→’22년 15%)
❙ 바이오의약품 부문별 제약성분 생산지 분포 ❙
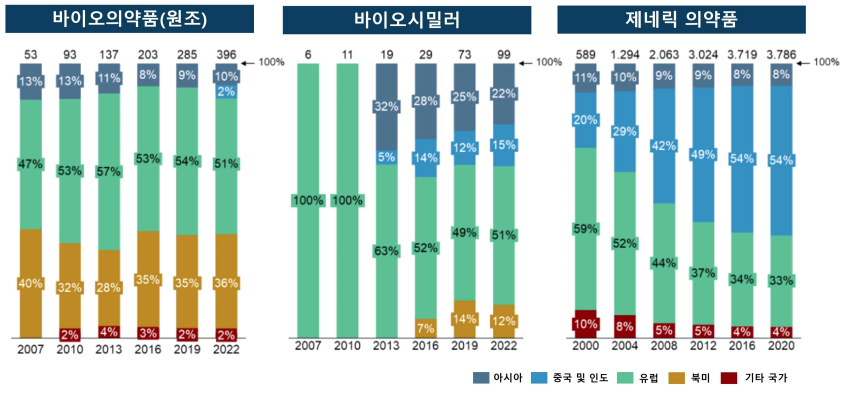
•︎ 아시아 제조기업, 특히 중국과 인도 기업은 바이오기술 생산의 전문성을 확장하고 있으며 바이오시밀러 개발에의 적극적 참여가 더욱 증가
- 바이오시밀러 제약성분 생산지로서의 아시아의 부상은 유럽 바이오의약품 생산 입지에 대한 경고로서 이해하는 것이 필요
[4] 정책 시사점
•︎ 서방 보건의료계는 비용 압박으로 인해 제네릭 의약품 생산을 아시아로 이전함으로써 공급 안전성에 문제가 발생하고 글로벌 바이오시밀러 시장에서의 유럽의 주도력 감소하고 있음에도 불구하고 독일 보건의료계는 바이오시밀러의 비용 절감 가능성만을 논의
•︎ 모든 보건의료시스템 주체들의 주요 임무는 바이오 의약품 공급망의 복원력과 공급 안전성을 보장하는 것이며 이것만이 지속가능하고 재정적으로 지탱할 수 있는 보건의료시스템을 달성
•︎ 종속성 축소와 공급 보안을 강화하기 위해 시작된 국가 차원의 첫 번째 조치의 핵심 목표는 제약성분의 탄력적 국내 생산과 해외 이전한 생산 현장의 리쇼어링이며 이는 곧 오늘날에도 여전히 존재하는 생산기지의 이전(오프쇼어링)을 무조건 방지해야 함을 의미
•︎ 바이오시밀러 부문은 아직 높은 공급 안전성이 특징이나, 동 부문 생산의 이전은 이러한 공급 보안을 파괴할 수 있어 보건의료시스템 복원력의 관점에서는 리쇼어링을 원한다면 오프쇼어링의 방지가 필요
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향

