산업동향
유럽EMA, 안전성 및 유효성 추적조사에 관한 가이드라인 - 첨단치료의약품의 위해성 관리
- 등록일2024-12-12
- 조회수607
- 분류산업동향 > 제품 > 바이오의약
-
자료발간일
2024-11-28
-
출처
한국의약품안전관리원
- 원문링크
-
키워드
#첨단치료의약품#ATMP#유전자치료제#줄기세포재생센터#규제과학센터
유럽EMA, 안전성 및 유효성 추적조사에 관한 가이드라인
- 첨단치료의약품의 위해성 관리
[첨단바이오포커스 제47호]
◈본문
국립줄기세포재생센터 공급 줄기세포치료제, 처음으로 임상시험 승인1
•︎ 질병관리청(이하 질병청) 국립보건연구원은 국립줄기세포재생센터 GMP** 제조시설이 제조·공급한 줄기세포치료제가 처음으로 식품의약품안전처(이하 식약처)와 보건복지부의 임상시험 및 임상연구계획 승인*을 받았다고 밝힘.
•︎ 국립보건연구원은 연구자들이 첨단재생의료 및 첨단바이오의약품의 개발 과정에서 겪는 기술적, 경제적 부담을 덜어주기 위해 국립줄기세포재생센터 GMP제조시설을 통해 위탁개발제조 서비스(이하 제조지원)를 제공하고 있음.
□ 국립줄기세포재생센터 GMP 제조지원 현황
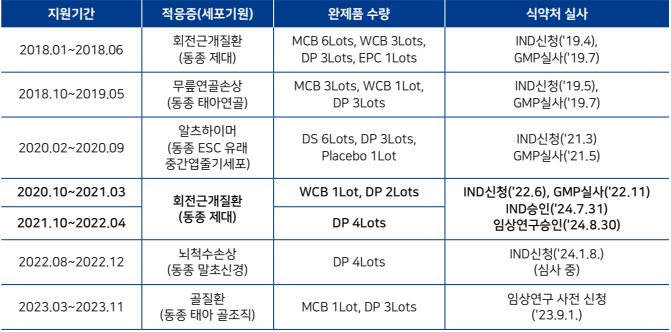
•︎ 제조지원 신청은 수시로 받고 있으며, 제조지원 대상은 제조시설 운영 심의위원회의 심의를 통해 선정하고 임상시험 또는 임상연구계획 신청에 필요한 제조 및 품질시험 등 품질관리체계 전반을 지원함. 현재 GMP 제조시설에서는 이번에 승인받은 줄기세포치료제를 추가 생산하여 임상연구 및 임상시험 추진에 차질이 없도록 제조지원 중임.
* 임상시험계획 승인(24.7.31.), 임상연구계획 승인(24.8.29.)
** GMP(Good Manufacturing Practice): 의약품 등의 제조나 품질관리에 관한 규칙으로 우수한 의약품을 제조하기 위해 원료 입고, 제조, 출하에 이르는 모든 과정에 필요한 관리기준을 규정
식약처, 「첨단바이오의약품의 품목허가·심사 규정」 일부개정고시 알림2
•︎ 식약처는 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」(이하 첨단재생바이오법) 제23조, 제27조, 제30조, 제36조, 제37조 및 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 시행령」 제29조, 「첨단바이오의약품 안전 및 지원에 관한 규칙」 제12조, 제14조, 제15조, 제24조, 제36조부터 제38조까지에 따른 「첨단바이오의약품의 품목허가·심사 규정」(식약처 고시 제2023-71호, 2023. 11. 23.)을 2024년 10월 7일 개정고시함.
•︎ 주요 개정 내용은 ▲"신약" 정의 신설(제2조제5호), ▲판매증명서 제출 면제 기준 마련(제5조제9항), ▲동물대체시험을 활용한 비임상시험 자료 제출 허용(제16조제1항), ▲신속심사 근거 마련(제21조의2) 등임.
•︎ 개정된 「첨단바이오의약품의 품목허가·심사 규정」 (식약처 고시 제2024-59호, 2024. 10. 7.)은 식약처 대표누리집(mfds.go.kr >법령/자료>법령정보>제개정고시등)에서 확인할 수 있음.
복지부, 범부처 재생의료기술개발사업 대표성과 발표회 개최3
•︎ 보건복지부(이하 복지부), 과학기술정보통신부(이하 과기정통부), 범부처 재생의료기술개발사업단은 2024년 10월 17일(목) 범부처 재생의료기술개발사업 대표성과 발표회를 개최함.
•︎ 범부처 재생의료기술개발사업은 복지부와 과기정통부가 공동으로 추진하는 국가연구개발사업(R&D)으로, 첨단재생의료 분야 핵심·원천기술 개발부터 치료제 및 치료 기술의 임상단계까지 전주기를 지원하며 현재까지 173개 과제를 선정하여 지원하고 있음.
•︎ 이번 대표성과 발표회에서는 1단계('21~'23년) 사업에서 도출된 연구 성과 중 우수한 성과를 선정하여 발표하였으며, 발표 내용은 ▲인간의 장과 유사한 전분화능줄기세포 유래의 장 오가노이드를 활용한 새로운 재생의료 치료제를 개발하기 위한 연구(한국생명공학연구원 손미영 박사)와 ▲세계 최초 자기 요유래 줄기세포를 이용한 만성신질환 환자 대상의 줄기세포 치료제 개발((주)이에이치엘바이오 강태욱 신약개발본부장)로 이와 관련된 자세한 내용은 다음과 같음.
전분화능줄기세포 정밀분화를 이용한 고성능 장 오가노이드(소장상피) 기술 및 활용 기술 개발

...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.

