BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공유전자치료제 연구동향 및 전망
- 등록일2015-02-24
- 조회수17269
- 분류레드바이오 > 의약기술
-
저자/소속
조정종 팀장/코오롱생명과학(주) 임상개발팀
-
발간일
2015-02-25
-
키워드
#유전자치료제 #바이오의약품
- 첨부파일
-
차트+
?
차트+ 도움말

1. 개요
지난 2012년은 유전자치료제의 새로운 서막을 여는 한해였다. ‘글리베라(Glybera②))'라는 유전자치료제가 선진국에서는 최초로 유럽 규제당국인 EMA(European Medicines Agency)의 최종 승인을 획득한 것이다. 유럽 규제당국으로부터 글리베라의 안전성과 유효성을 검증받은 유니큐어社(UniQure, 네덜란드)는 미국 FDA에도 승인신청을 하였으며, 곧 미국에서도 최종 승인을 획득한다면, 최대 선진 시장인 미국에서도 유전자치료제 시장이 열리게 될 것이다. 1989년 사람을 대상으로 한 첫 유전자치료제 임상시험이 시작된 지 약 23년만의 업적이었으며, 지난 1999년, 유전자치료제 역사에서는 결코 잊혀질 수 없는 Jesse Gelsinger 사건 이후로 불투명하기만 하던 유전자치료제의 안전성이 선진 규제당국을 통해서 입증된 순간이었다.
유전자치료는 크게 두 가지 분류, 즉 체세포 유전자치료(Somatic gene therapy)와 생식세포 유전자치료(Gemline gene therapy)로 구분된다. 체세포 유전자치료는 치료 유전자를 체세포에 삽입하지만, 그 유전자가 다음 세대로 전달되지 않는다. 하지만, 생식세포 유전자치료의 경우 치료 유전자 또는 변형된 유전자가 다음 세대로 전달될 수 있는 잠재적 위험성이 있다. 현재 전세계 국가에서 생식세포 유전자치료는 법률로 엄격하게 금지하고 있기 때문에, 본 자료에서는 체세포 유전자치료에 대해서만 다루고자 한다.
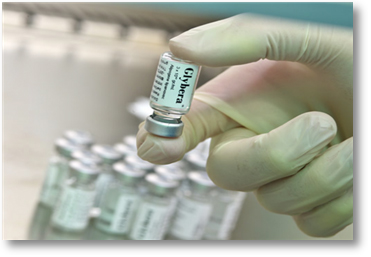
출처: Pharmafile.com, Published on 24/07/12
가. 유전자치료제의 역사
1980년, 마틴 클린(Martin Cline)은 재조합 DNA를 이용하여 유전자치료를 처음으로 시도하였다. 그는 두 명의 베타 지중해성 빈혈(β-thalassemia) 환자를 대상으로 임상시험을 수행하였다. 하지만 이 임상시험은 UCLA 기관윤리위원회 (Institutional Review Board, IRB)의 승인을 받지 않고 진행한 문제점이 있었다.
1988년, NIH 재조합 DNA 자문 위원회(Recombinant DNA Advisory Committee, RAC)의 승인을 받은 최초의 외부 유전자 도입 인체실험이 시도되었다. 하지만 이 경우는 실제 치료를 위한 임상이 아니었으며, 암 환자 내에서 종양 침투성 림프구(Tumor-infiltrating Lymphocytes, TIL)에 마커 유전자(marker gene)를 이용하여 TIL과 항 종양 효과간의 상관관계를 밝히고자 한 연구였다. 이 임상 시험을 신청했던 로젠버그(S.A. Rosenberg)는 그 이후에 TNF(Tumor Necrosis Factor)를 도입한 TIL을 이용하여 말기 흑색종 환자를 대상으로 한 임상을 수행하였다.
1990년 9월, 중증 면역결핍 증후군의 일종인 ADA-SCID (Adenosine Deaminase Deficiency)를 대상으로 한 유전자치료 임상시험이 마침내 미국 FDA의 공식적인 승인을 최초로 획득하였으며, 두 명의 어린이 환자를 대상으로 한 유전자치료 임상이 실시되었다. FDA로부터 최초의 유전자치료가 승인된 후 10여 년 동안 유전자치료법 개발이 급속히 발전하는 과정에서 유전자치료 분야에 경각심을 울린 두 가지 사고가 발생하였다. 1999년 당시 18세였던 제시 겔싱어(Jesse Gelsinger)는 오르니틴 트랜스카바밀라아제 결핍증(Ornithine transcarbamylase deficiency)이라는 유전질환을 앓고 있었는데, 이를 치료하기 위한 유전자 치료를 받는 과정에서 유발된 전신 면역 반응으로 인하여 투여 4일 만에 사망하였다. 또한 2000년에는 유럽에서 진행된 중증면역결핍증(SCID)을 치료하기 위한 유전자치료 임상시험을 하는 과정에서, 치료를 받은 환자들 중 5명에게서 백혈병이 발병하였고, 이 중에서 1명이 사망하였다. 이 두 사고가 발생한 직후, 미국과 유럽 규제 당국에서는 위험-이익 접근법(Risk-Benefit Assessment)를 통해 유전자치료가 환자에게 가져다 줄 수 있는 잠재적 이익이 잠재적 위험을 상회하는 경우에만 임상 진행을 승인하게 되었다.
2003년, 중국에서 최초의 유전자치료제가 상업화되었다. 시비오노 젠텍社(SiBiono Gene Tech, 중국)에서 개발한 젠디신(GendicineTM)은 아데노바이러스 벡터를 이용하였으며, 두경부암에 대한 치료제로 중국 식약처(State Food and Drug Administration, SFDA)의 허가를 받았다. 하지만, 젠디신은 임상 3상 결과가 없이 승인을 받은 사례였다. 2005년, 중국에서 또 다른 유전자치료제인 온코린(OncorineTM)이 화학요법을 병행한 말기 비인두암을 치료 타깃으로 중국 식약처의 판매 승인을 획득하게 된다. 상하이 선웨이 바이오텍社(Shanghai Sunway Biotech, 중국)에서 개발한 온코린은 암세포에서만 선택적으로 복제하는 특성을 가진 아데노바이러스 기반의 유전자치료제였다. 그 이후 2007년과 2011년에 필리핀과 러시아에서 각각 암과 중증 하지허혈에 대한 유전자치료제가 판매 승인을 획득하였다.
2012년 10월, 유럽 규제당국인 EMA는 마침내 희귀 유전성 질환인 가족성 지질단백 분해효소 결핍증(Familial Lipoprotein Lipase Deficiency, LPLD)을 치료할 수 있는 글리베라(Glybera②)에 대한 최종 판매 승인을 결정하였다. 이를 통해서 선진국 최초의 유전자치료제가 시장에 출시되게 되었으며, 유전자치료제의 상업화 가능성이 가시적으로 입증되었다.
...................(계속)
* 로그인 하셔야 자세한 정보를 모두 보실 수 있습니다.
-
이전글
- 줄기세포치료제 동향 및 전망
-
다음글
- 바이오시밀러 개발현황 및 전망
지식
동향


 유전자치료제 연구동향 및 전망.pdf
유전자치료제 연구동향 및 전망.pdf
 유전자 치료제 Glybera
유전자 치료제 Glybera