BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공유전체 교정을 통한 질병치료기술 (Genome editing-based gene/cell therapy)
- 등록일2017-04-28
- 조회수14343
- 분류생명 > 생물공학, 레드바이오 > 의료서비스기술
-
저자/소속
홍영빈 연구소장/㈜툴젠
-
발간일
2017-04-28
-
키워드
#유전체 교정#미래유망기술
- 첨부파일
-
차트+
?
차트+ 도움말

1. 개요
가. 기술의 정의
(1) 유전체 교정
과학기술 전반의 비약적인 발전에 힘입은 생명과학 분야의 기술적 진보는 21세기 생명과학의 서막으로 인간 유전체 분석이라는 기념비적 업적을 이루게 되었다. 곧바로 개발된 차세대 염기서열 분석법 (next generation sequencing)은 유전 정보 분석에 기반한 생명현상에 대한 이해의 폭을 급진적으로 넓히고 있고 있으며, 특히 동식물의 발생과 성장 및 질병과 유전정보의 상관성에 대한 정보제공은 인류의 생활 방식에 큰 영향을 미치고 있다.
유전체 교정 (genome editing)이란 생명체의 유전정보를 임의로 수정하는 기술이다. 유전자가위를 이용한 유전체 교정 기술은 기존의 유전자 조작 기술에 비해 수천 배 이상의 높은 효율을 지니고 있으므로, 연구실에서의 정교한 실험 수행을 가능하게 하고, 이를 바탕으로 생명공학산업 및 의료분야까지 그 활용성을 단기간에 확장시키고 있다. 유전체 교정 기술은 인간을 포함한 동물, 식물, 미생물의 유전정보를 변화시킬 수 있으며, 특히 인간 질병과 관련된 유전정보를 교정하는 기술과, 인간이외의 다른 생물체의 유전 정보를 변경하여 유익한 생물 자원을 생산하는 산업은 최근 몇 년간 비약적으로 발전하고 있다. 이러한 특징으로 인해유전체 교정기술은 기술 개발의 역사가 매우 짧음에도 불구하고, 연구/산업/치료용 응용이 종합적으로 동시에 개발되는 특징을 보이고 있다.
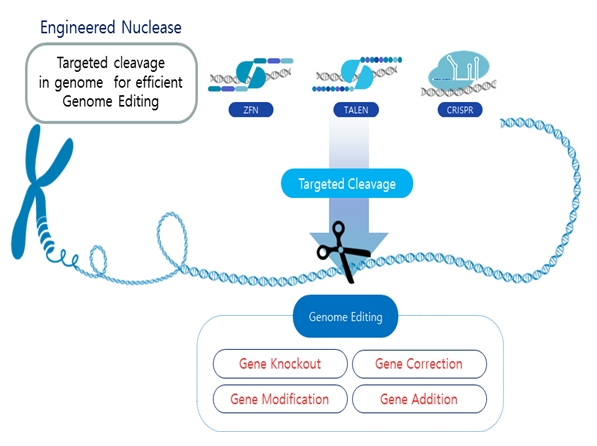
[그림 1. 유전자가위를 이용한 유전체 교정 기술의 응용]
(2) 유전체 교정 기술의 원리
유전체 교정 기술의 핵심은 유전자가위이다. 유전자가위는 원하는 유전정보를 정확히 자를 수 있도록 설계되어 제작되는 분자 도구이다. 유전자가위는 2000년대 중반 1세대 유전자가위인 zinc finger nuclease (ZFN)가 개발된 이래 지속적인 혁신을 통해 2세대 유전자가위인 tranion activator-like effector nuclease (TALEN)을 거쳐 현재는 3세대 유전자가위인 CRISPR/Cas9 (또는 RNA-Guided ENdonuclease, RGEN)까지 혁신적인 유전자가위가 개발되어 왔다. 이러한 기술적 진보로 유전체 교정 기술은 2011년 nature methods에서 올해의 기술, 2013년 science에서 breakthrough of the year로 선정하는 등 학계의 넓은 관심을 반영하고 있다.
현재까지 개발된 유전자가위 중 meganuclease, ZFN, TALEN은 단백질-DNA 결합을 통해서 타겟 서열을 인식한다. ZFN을 제작하기 위해서는 굉장히 복잡한 단백질 공학이 필요하지만, TALEN은 각각의 모듈이 인식하는 핵산이 정해져 있어서 약간의 복잡한 클로닝 작업만을 필요로 한다. [1, 2, 3] 그러나, 이러한 기술들은 실제 적용을 위해 매우 긴 준비시간이 필요한데, 이들과 달리 Cas9의 경우, 이 핵산분해효소를 타겟으로 유도하기 위해 가이드 RNA를 사용하므로 제작에 소요되는 시간이 굉장히 짧고, 다양한 타겟을 동시에 사용하여 한 번에 유전체 내 여러 부위에 동시에 이중 가닥 절단을 유도할 수 있다.
[표 1. 유전자가위들의 특성 비교]
특징 | ZFN | TALEN | CRISPR-Cas9 |
인식부위 | 9~18 bp (monomer) 18~36 bp (dimer) | 14~20 bp (monomer), 28-40 bp (dimer) | 23 bp (20 bp guide sequence + 3 bp PAM sequence (Sp.Cas9)) |
구성 | DNA binding domain + FokI nuclease Dimer | DNA binding domain + FokI nuclease Dimer | DNA binding guide RNA + Cas9 protein |
표적 제한 | Non G- rich 부위 표적이 어려움 | 표적 부위의 5’말단이 T여야 함 | 표적 부위 뒤에 PAM 서열이 존재해야 함 |
효율 | ++ | ++ | +++ |
특이성 | +++ | +++ | ++ |
제작 용이성 | 상당한 단백질 공학이 요구됨 | 복잡한 cloning이 요구됨 | 쉬움 |
다중 표적 | 어려움 | 어려움 | 쉬움 |
Ex vivo 전달 | 비교적 쉬움 | 비교적 쉬움 | 비교적 쉬움 |
In vivo 전달 | 비교적 쉬움 크기 작음 | 어려움 내재적인 서열 유사성으로 재조합 가능성 있음 크기가 큼 | 보통 Sa.Cas9, Cj.Cas9 등 작은 Cas9 이용이 요구됨 |
유전자가위에 의해서 타겟 염기서열의 이중 가닥에 절단이 생기면 세포 주기 및 상동유전체의 유무에 따라서 non-homologous end joining (NHEJ) 또는 homology-directed repair (HDR)에 의해서 복구된다. NHEJ는 잘린 두 이중 가닥 절단을 다시 이어주는 방식인데, 이때 염기 서열의 삽입(insertion)이나 결손(deletion)이 발생할 수 있으므로, coding exon 중에 NHEJ가 일어날 경우 frameshift 변이를 유도할 수 있고, 결과적으로 단백질의 기능을 억제할 수 있다. HDR은 상동 염기서열을 주형(template)으로 변이가 일어난 부분을 수리하는 방법인데, 만약 외부에서 이중 가닥 절단 부위 양쪽에 상동성을 가진 주형 DNA를 전달해준다면 그 주형을 바탕으로 절단된 부위를 복구한다. HDR은 세포 분열시기에서 주로 일어나고, NHEJ에 비해서는 빈도가 낮은 단점이 있으나, 주형 DNA를 바탕으로 단백질의 결손 없이 복구가 이루어질 수 있는 장점이 있다.
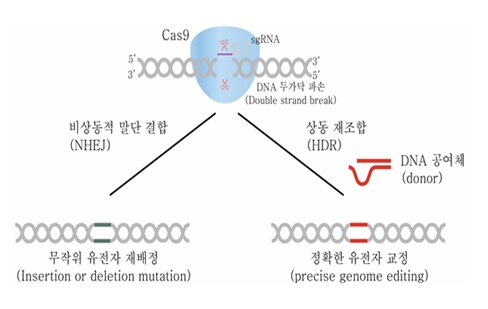
[그림 2. 세포내 DNA repair system을 이용한 CRISPR/Cas9의 작용 기작]
나. 특징 및 적용 분야
현재까지 유전질환을 일으킨다고 알려진 유전자들은 3,000개 이상 보고되어 있고, 지속적인 진단의학 및 NGS에 기반한 유전자 분석 기술의 발전과 적용에 의해 향후 유전질환과 관련된 4,000~7,000개 정도의 유전자들이 추가로 밝혀질 것으로 예상된다. [4] 그러나, 진단 기술의 발전에도 불구하고 아직까지 각 유전질환별 치료제 개발은 여전히 요원한 상태이다. 최근 괄목할 만한 기술적 발전을 이어나가고 있는 유전자교정 기술은 유전자 치료법의 핵심기술로 대체되고 있으며, 이러한 미충족 수요를 해결할 것으로 기대되고 있다. 유전자치료는 질병을 유발하는 유전자의 돌연변이에 의한 기전을 정상으로 되돌리기 위해 돌연변이를 정상형태로 교정하거나, 유전자의 발현량을 억제하고, 변이 유전자를 대체할 수 있는 다른 유전자의 발현량을 증가시키기 위해 외부에서 유전자를 도입시키는 치료법을 일컫는다. 최근 CRISPR/Cas9을 이용한 유전자교정은 이러한 기술적 수요를 모두 충족시킬 수 있는 유전자치료 기술로서 각광받고 있다.
또한, 유전체 교정 기술은 그 교정이 일어나는 위치에 따라서 체내 유전체 교정(in vivo genome editing)과 체외 유전체 교정 (ex vivo genome editing) 두 가지로 크게 분류할 수 있다. 유전질환을 대상으로 주로 개발되는 체내 유전체 교정과 달리, 외부로 추출된 세포를 대상으로 유전자 교정을 수행하고, 이를 환자 체내로 다시 주입하여 치료하는 체외 유전체 교정 기술은 주로 면역계 질환과 암환자를 대상으로 한 세포치료법의 기술적 대안으로 주목받고 있다.
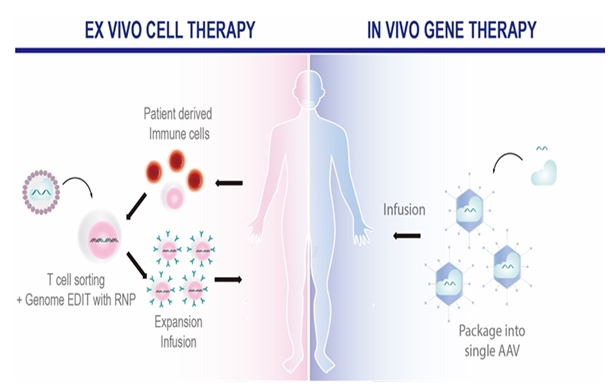
[그림 3. 세포내 DNA repair system을 이용한 CRISPR/Cas9의 작용 기작]
2. 최근 연구동향 및 주요 이슈
가. 최근 연구동향
(1) 유전자치료제 개발 동향
유전자가위 기술 이전의 유전자치료제는 대부분 특정 유전자를 체내로 전달하는 방식을 주요 치료적 기전으로 활용해 왔다. 이러한 방법은 체내에서 특정 유전자의 발현을 유도하는 방식만 활용하는 것으로 다양한 치료적 모델을 제시하기가 어려웠다. 이에 비해 유전자가위를 활용할 경우, 질병 유발 유전자의 삭제, 변이의 교정, 유전자의 삽입, 과발현 유전자의 발현 조절 등 다양한 방식의 치료적 모델을 제시할 수 있으므로, 치료제로서의 활용도가 무한히 확장될 수 있다.
유전자 정보를 in vivo로 전달하기 위해서는 각 타겟 장기로의 전달이 명확해야 하는데, 현재까지 모든 장기로의 효율적인 유전자 치료제 전달은 쉽지 않다. 이로 인해 CRISPR/Cas9관련 체내 유전체 교정 치료제 개발은 현재 수준에서 비교적 전달이 용이한 장기들인 간, 눈, 근육 피부 관련 질환 등에 대한 연구가 진행되고 있고, 동물모델을 이용한 성공적인 사례는 임상적용 가능성을 높이고 있다.
심혈관질환의 주된 원인으로 알려진 low-density lipoprotein cholesterol (LDL-cholesterol)의 혈중농도를 조절하는 pro-protein convertase subtilisin/kexin type 9 (PCSK9)을 SaCas9을 이용한 NHEJ형식으로 knockout시키기 위해 간세포 (hepatocyte)에 바이러스 친화성을 띈다고 알려진 adeno-associated virus serotype 8 (AAV8)을 이용한 연구가 마우스에서 진행 되었다. 40% 정도의 insertion 혹은 deletion (indel) 돌연변이가 PCSK9 locus에서 유도되었고, 이는 혈중 PCSK9의 90%와 LDL-cholesterol 40% 수치의 저하로 이어졌다. [5] 유사한 방식으로 PCSK9을 knockout 시키는 연구는 SpCas9와 AAV 벡터를 이용한 사례가 있었고, 이때 인간화 (humanized) 마우스를 이용한 마우스모델을 적용하여 비슷한 효과를 얻었다. [6,7]
AAV8과 이용하여 ornithine transcarbamylase (OTC) 결핍증의 마우스모델을 치료한 사례에서는 두개의 AAV 벡터를 이용하여 SaCas9와 HDR donor, sgRNA를 정맥주사로 전달하여 10% 정도의 유전자 교정 (homology directed repair) 효율을 증명했다. [8] OTC 결핍증은 고암모니아혈증 (hyperammonemia)을 유발하여 암모니아 중독에 의한 지능장애와 반복성구토 등의 증상이 나타나고, 생명에 치명적이어서 치료제 개발이 시급한 상황인데, CRISPR/Cas9을 이용하여 이러한 대사성질환 (metabolic disease)에 대한 근본적인 치료대안이 마련되었다고 여겨진다.
[표 2. CRISPR/Cas9을 이용한 동물모델에서의 치료효능]
타겟유전자/타겟질환 | 전달방법 | 유전자교정법 | 장기 | 참고문헌 |
Pcsk9/hypercholesterolemia | AAV8 | NHEJ | 간 | 5 |
Dual AAV8 | NHEJ | 간 | 6 | |
Dual AAV8 | NHEJ | 간 | 7 | |
지질 나노입자 | NHEJ | 간 | 9 | |
OTC/OTC 결핍증 | AAV8 | NHEJ | 간 | 8 |
DMD/듀켄씨근이영양증 | AAV9 | NHEJ | 간 | 10 |
AAV8 | NHEJ | 간 | 11 | |
Dual AAV9 | NHEJ | 간 | 12 | |
MSTN/악액질 | AAV8 | NHEJ | 근육 | 13 |
Vegfa, Hif1a, Hif2a/노인성황반변상 | AAV-Dj | NHEJ | 눈 | 14 |
RNP-Liposome | NHEJ | 눈 | 15 | |
HIV DNA/AIDS | AAV8 | NHEJ | Systemic | 16 |
Fah/유전성 티로신 혈증 I | Hydrodynamic 주사 | HDR | 간 | 17 |
AAV + 지질 나노입자 | HDR | 간 | 18 | |
Hpd/유전성 티로신 혈증 I | Hydrodynamic 주사 | NHEJ | 간 | 19 |
HBV DNA/B형 간염 | 지질 나노입자 | NHEJ | 간 | 20 |
수포성표피박리증 | RNP-Liposome | NHEJ | 피부 | 21 |
근육도 간과 더불어 유전자 물질을 전달하기 좋은 장기이다. 듀켄씨근이영양증 (Duchenne muscular dystrophy)은 DMD 유전자 exon 23의 결함에 의해 발생할 수 있는데, DMD 단백질 말단부분이 없어도 정상적인 기능을 하므로, CRISPR/Cas9을 이용한 exon-skipping 전략으로 듀켄씨근이영양증의 마우스 모델에서 치료 효능을 입증하였다. AAV8/9과 SpCas9/SaCas9을 이용하여 DMD exon 23을 효과적으로 제거하고, 골격근에서 DMD 단백질 발현을 회복시켜 기능을 향상시켰다. [10,11,12] 특히 듀켄씨근이영양증 환자는 심근 (cardiac muscle)의 DMD 저하로 인한 심장마비가 치명적으로 알려져 있는데, 동맥주사로 전달할 경우 심근의 DMD 단백질 발현 및 기능을 회복함으로서 질병모델의 생존을 늘렸다.
눈은 다른 장기에 비해 외부로 노출되어 있고 면역 격리되어 (immune privileged) 있어 유전물질 전달이 용이 하다고 간주되고 있다. 안질환 중 노인성황반변성 (Age-related macular degeneration)의 진행에 강한 연관성을 가진 신혈관 형성 (neovascularization)을 억제하기 위해, AAV의 일종인 AAV-DJ를 사용하여 망막상피세포 (retinal epithelial cell)로 신혈관 형성에 중요한 역할을 하는 VEGFA (vascular endothelial growth factor alpha)와 HIF1A (hypoxia inducible factor 1 alpha)를 제거하는 sgRNA와 CjCas9을 효율적으로 단일벡터로 전달하였다. [22] 이 연구는 단일벡터로 VEGFA 혹은 주요 downstream signal인 HIF1A를 유전자 수준에서 타겟하여 치료효능을 입증한다는 점에서, 기존의 치료법인 VEGFA에 대한 단일클론성항체의 지속적인 투여를 대체할 치료법 개발로서의 가능성을 제시하고 있다.
비유전성 (non-genetic) 안질환 외에 유전성 안질환 중 가장 많은 연구가 이뤄진 질환으로는 레버 선천성 흑내장 (Leber congenital amaurosis; LCA)이 있다. 이 질환 환자중 20%는 CEP290 유전자의 intron 26에 c.2991+1655 A>G 돌연변이가 생겨 CEP290 단백질에 splicing이 일어나게 되는데, Editas Medicine에서 돌연변이 주위의 intron 26에 두개의 sgRNA와 SaCas9을 AAV에 package하여 치료하는 전략으로 환자에서 유래한 섬유아세포 (fibroblast)와 영장류에서 치료 효능을 검증 하였다 (www.editasmedicine.com).
CRISPR/Cas9을 이용하여 인간에게 치명적인 바이러스의 유전체를 제거할 수도 있다. 그 예로, SaCas9과 5' LTR과 Gag gene을 타겟한 sgRNA를 AAV8에 package하여 AIDS를 유발하는 HIV를 효율적으로 마우스와 랫드에서 제거한 사례가 보고되었다. [16] HIV는 스스로 복제하는 단계에서 높은 돌연변이 확률이 존재하므로 동시에 여러 sgRNA을 이용하여 다수의 HIV 유전자를 타겟할 경우 HIV의 escape 확률을 크게 줄일 수 있고, 바이러스 유전자의 돌연변이가 지속되어도 제거할 확률이 높아 HIV 치료제로서 유망할 것으로 전망된다.
HDR (homology-directed repair)를 이용할 경우 유전자를 치환할 수 있다. in vivo에서 HDR donor를 이용하여 마우스의 간에서 유전자교정을 실시한 사례가 보고되었다. [17] 이 연구에선 티로신 이화작용 (tyrosine catabolism)에 있어 마지막으로 필요한 효소인 fumarylacetoacetate hydrolase을 coding하는 FAH 유전자에 돌연변이가 생겨 발생하는 유전성 티로신 혈증 I (hereditary tyrosinemia type I)에 대하여 CRISPR/Cas9를 이용하여 정확히 마우스 모델에서 유전자 교정을 한 연구로, 비록 전체 간세포의 0.4%가 유전자 교정되는 효율을 보였으나, 교정된 간세포가 Fah가 knockout된 간세포보다 생존상의 이점이 있고, 간세포의 재생능력을 고려하면 치료적 효과는 유의하다고 할 수 있다.
...................(계속)
* 로그인 하셔야 자세한 정보를 모두 보실 수 있습니다.
-
이전글
- 생체 내 직접교차분화기술
-
다음글
- 단일세포 유전체 분석기술
지식
동향


 유전자교정을 통한 질병치료기술.pdf
유전자교정을 통한 질병치료기술.pdf
 유전자가위를 이용한 유전체 교정 기술의 응용
유전자가위를 이용한 유전체 교정 기술의 응용
 유전자가위들의 특성 비교
유전자가위들의 특성 비교