BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공인공효소 체인
- 등록일2018-04-26
- 조회수15095
- 분류플랫폼바이오 > 바이오기반기술
-
저자/소속
정흥채 책임연구원/한국생명공학연구원 바이오합성연구센터
-
발간일
2018-04-26
-
키워드
#인공효소 체인#미래유망기술
- 첨부파일
-
차트+
?
차트+ 도움말

1. 기술의 정의
가. 효소체인반응(enzyme chain reaction)이란?
세포내 대부분의 대사과정은 기질(substrate)로부터 효소를 이용해 촉매반응(catalysis)을 통해 산물(product)을 생산하는 과정이 연속적으로 이루어져 있다 (그림 1). 반응을 촉매하는 효소가 연속적으로 작용하고 구성되어 있기 때문에 효소체인반응(enzyme chain reaction)이라고 한다.
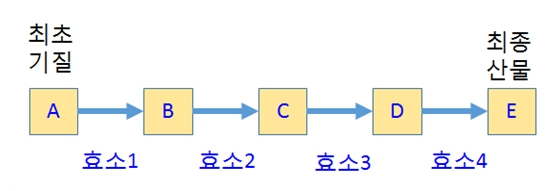
[그림 1] 효소체인반응(enzyme chain reaction)의 개념도
이렇게 효소반응이 연속적으로 이루어져 있는 세포내 대사과정을 대사경로(metabolic pathway)라고 한다. 세포내 대사경로를 구성하고 있는 대사반응들을 잘 살펴보면 자유롭게 유리된 상태의 효소들에 의한 효소반응의 형태가 아니고, 효소들이 세포막에 붙어서 서로 연결되어 있는 다중효소 복합체(multi-enzyme complex)로 구성되어 있는 경우가 다수 발견된다. 이러한 효소 고분자들의 구조적 재구성은 세포내 1차 대사과정(primary metabolism)과 2차 대사과정(secondary metabolism)에서 많이 발견된다. 왜 그럴까? 2가지 측면에서 살펴볼 수 있는데, 한 가지측면은 차례대로 나열되어 있는 효소들의 촉매반응 활성부위들 사이를 이동하는 중간대산물의 채널링(channeling)효과이고 또 다른 측면은 촉매하는 효소들이 같은 장소에 존재하게 만드는 공존(colocalization) 효과를 노리는 것이다. 이러한 채널링효과와 공존효과의 결과는 전체 대사경로 반응의 효율성(efficiency), 특이성(specificity) 및 대사경로의 조절(regulation) 측면에서 세포에게 유리하게 작용한다.
나. 자연계 효소체인(naturally occurring enzyme chain)
자연계에 대사과정의 효율성을 높이기 위하여 다양한 효소체인이 존재한다(그림 2). 효소체인을 형성하고 있는 대표적인 1차대사과정은 핵심탄소대사과정(central carbon metabolism), 지방산산화과정(fatty acid oxidation), 캘빈 사이클(Calvin cycle), 아미노산 생합성, carboxysome, 그리고 proteasome 등이 있다.
자연적으로 또는 진화적으로 효소체인을 형성하기 위하여 세포는 어떤 전략을 사용하는가?
채널형태를 만들기 위해서 세포내 효소들이 가깝게 존재하여야 한다. 이러한 목표는 세포질에 존재하는 고분자물질이 고농도로 존재하면 서로 희석된 상태보다 국부적으로 훨씬 높은 농도를 유지할 수 있고, 효소의 움직임이 낮아 확산되지 않아 반응 후 효소가 멀리 유리되지 않고 한곳에 머물러 체인반응을 하기 유리한 조건을 만들 수 있다. 대장균의 세포질은 효소를 비롯한 고분자들이 20-30%(v/v)의 농도로 존재한다. 실험실적 효소반응을 연구하는 낮은 농도의 용액보다는 매우 높은 농도이고, 결과적으로 반응속도는 수십배이상의 효과를 나타낸다. 고농도의 세포질 환경은 구성물질들이 다닥다닥 붙어 있는 붐비는 조건을 만들어 대사과정의 효소들이 서로 반응이 연속적으로 바로 바로 일어나게 하는 대사채널링(metabolic channeling) 또는 기질채널링(substrate channeling) 효과를 나타낸다.
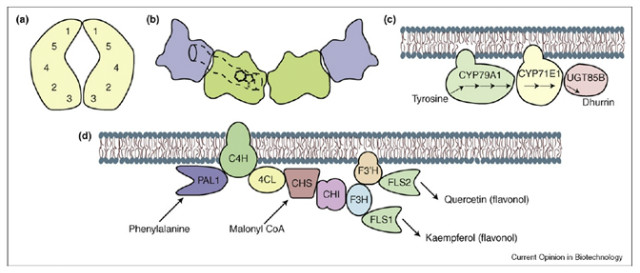
[그림 2] 자연계에 존재하는 효소체인들의 예. (a) 하나의 단백질에 5개의 효소활성부위를 갖는 곰팡이 AROM복합체, (b) 물리적 채널을 형성하고 있는 tryptophan synthase 복합체, (c) dhurrin합성에 관여학 있는 효소체인, (d) 식물에서 phenylpropanoid 대사에 관여하는 ER(소포체)막 효소체인 (Conrado et al., Curr. Op. Biotech., 2008, 19:492-499)
자연계에 존재하는 효소체인반응의 대사채널링효과는 다음과 같은 장점을 지닌다. 첫째, 연속적인 반응을 촉매하는 효소의 촉매작용 활성부위가 충분히 가깝게 존재하여 반응과정 중에 생성되는 중간산물이 확산되어 반응체인을 벗어나는 것을 방지할 수 있다. 만약 중간산물이 효소촉매 활성부위에서 멀리 벗어난다면, 반응속도를 낮추거나 독성물질의 경우 세포의 다른 부위를 공격하여 세포의 생존율을 낮출 수 있고, 또한 다른 효소의 작용으로 부산물이 생성될 수 있다. 둘쩨, 국부적으로 고농도의 효소를 유지할 수 있고, 국부적으로 중간산물의 농도는 높지만 세포전체적으로는 낮은 농도를 유지할 수 있다. 이는 중간산물이 독성이 있는 경우 세포전체에 미치는 영향을 최소화할 수 있는 장점이 있다. 또한 효소촉매도 세포전체에 고농도로 발현시켜 가지고 있을 필요가 없어 세포에 부여되는 대사스트레스량을 낮출 수 있다. 셋째, 대사조절 관점에서 매우 유리하다. 같은 기질을 놓고 경쟁하는 대사경로의 경우 세포내 요구도에 따라 대사경로 전체를 조절할 수 있다.
다. 인공효소체인 (artificial enzyme chain)
세포를 활용하여 유용한 물질을 생산하려고하는 엔지니어링 관점에서 보면 자연계에 존재하는 대사과정은 결과적으로 낮은 생산성(productivity)와 낮은 수율(yield) 뿐만 아니라 원하지 않는 부산물을 생산하기 때문에 산업적 활용도가 떨어진다. 이러한 중요 생산공정 변수를 개선하기 위해 대사공학 기술 또는 합성생물학 기술을 적용하여 왔다. 이들은 주로 효소활성을 개량하거나 각각의 유전적 요소 또는 유전자네트워크 전체를 리프로그래밍하는 방법이 활용되었으나, 대사경로에 참여하고 있는 효소들의 세포내에서의 공간적 재구성에 대해서는 관심을 두지 않았다. 하지만 이미 살펴보았듯이 자연계의 효소체인 반응이 생산공정의 핵심 변수인 생산성(productivity), 수율(yield), 농도(titer) 측면에서 매우 유리한 전략을 제공한다는 점을 제고할 필요가 있다.
따라서 인공효소체인(artificial enzyme chain)이라함은 자연계에 존재하는 효소체인을 모사하여 대사반응을 연속적으로 촉매하는 효소들을 세포내에 공간적으로 근접하게 형성되도록 재구성한 효소 케스케이드 반응계(enzyme cascade reaction system)로 정의할 수 있다. 인공효소체인의 구성은 대사산물을 생산하는 합성경로를 통한 흐름(flux)를 증가시켜 세포의 생산성을 증가시키고 원치않는 부산물 생산을 줄여 최종 농도를 높일 수 있는 가장 최근의 기술적 노력이라 할 수 있다.
이러한 인공효소체인은 다중효소 케스케이드(multi-enzyme cascade), 메타볼론(metabolon), 인공효소채널(artificial enzyme channel)등으로도 불리우고 있다.
2. 국내외 동향
가. 국외 동향
인공효소체인 기술은 분자생물학 기술을 활용한 융합단백질 발현기술, 효소들을 서로 근접하게 고정화하는 기술, 그리고 단백질, 핵산, 또는 폴리머를 스카폴드로 이용한 나노기술 등으로 분류할 수 있다.
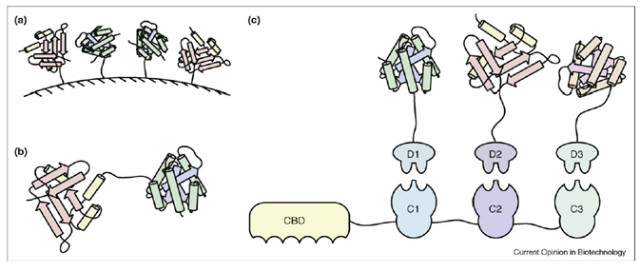
[그림 3] 다양한 인공효소체인 기술들. (a) 고정화효소 시스템, (b) 융합단백질 시스템, (c) 스카폴드를 이용한 인공효소체인 (Conrado et al., Curr. Op. Biotech., 2008, 19:492-499)
1) 고정화 효소 시스템
연속된 반응을 촉매하는 효소들을 폴리머파티클 표면에 고정화하여 효소들이 무작위적이지만 공간적으로 근접하게 존재하도록 하는 기술이다(그림 3(a)). 몇 가지 사례를 통해서 반응속도론적인 측면에서 장점이 있음이 확인되었다. 하지만 고정화과정에서 연속된 효소들이 순차적으로 고정화할 수 없고, 반응단계가 많아 고정화되는 효소수가 많아지면 속도가 감소할 수 있는 단점도 있는 인공효소체인의 초기기술에 해당한다. 매우 초기에는 2-3개의 효소가 고정화된 연속반응의 경우 최종산물의 생산이 140%이상 증가 하였다고 보고하였다(1). 여러 효소를 화학적으로 가교결합하여 효소복합체를 만들어 인공효소체인을 시도하기도 하였으나, 모두 기술적 어려움과 스케일업의 문제로 크게 활용되지는 못했다.
2) 융합단백질 시스템
분자생물학적으로 연속반응에 관여하는 두 개의 효소를 융합단백질 형태로 발현하여 한 개의 폴리펩타이드를 형성하게 하는 기술은 이제 매우 광범위하게 활용되고 있다 (그림 3(b)). 예를 들어 대장균 유래 β-galactosidase (LacZ, tetramer)와 galactokinase (GalK, monomer)의 융합단백질은 lactose로부터 2단계 반응을 통해 galactose-1-phosphate로 전환한다. 그러나 이러한 2단계 반응을 위한 융합단백질기술은 기술적 단순함과 생산의 용이함 측면에서 장점이 있지만, 속도론과 효소 공학적 변수의 측면에서는 크게 유리하지는 않았다.
시험관 실험에서 두 효소 (choline dehydrogenase(CDH)/betaine aldehyde dehydrogenase(BADH))간의 근접성을 제공하기 위해 융합단백질을 만들고 세포내와 같은 환경을 제공하기 위해 크라우딩촉진제(crowding agent)인 폴리에틸렌글리콜(polyethylene glycol)을 효소반응용액에 첨가했을 경우, 반응용액의 점성은 8배 이상 증가하고 분자들의 확산은 크게 줄었으며 효소반응은 120%가 증가하였고 세포내에서는 비슷한 결과를 나타냈다.
[표 1] 융합단백질기술을 활용한 인공효소체인사례
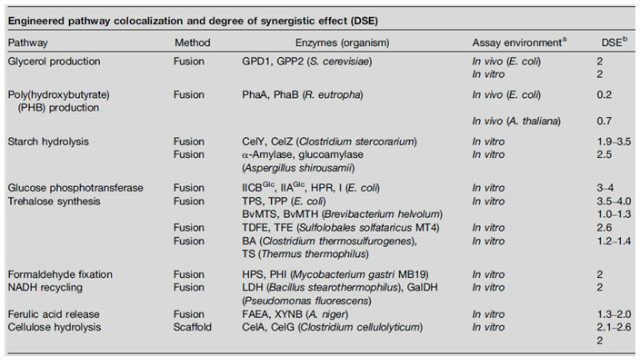
이러한 결과로부터 유리된 단일 효소에 의한 연속반응보다 융합단백질을 만들어 효소가 근접하게 하면 기질의 채널링효과가 증가하고 결과적으로 속도론적인 측면에서 장점이 있음을 알 수 있다. 하지만, 융합효소단백질의 기질채널링 효과가 개선된 연구보고는 많지만, 실험관에서처럼 세포내에서 그대로 적용된 사례는 많치가 않다 (표 1).
3) 스카폴드를 이용한 인공효소체인
융합단백질을 이용한 인공효소체인을 쉽게 만들 수 있는 기술과 최근 발전된 나노기술은 3개 이상의 효소단백질들을 보다 복잡하지만 세포내에서 효소의 방향성, 농도, 개수, 접근성을 인위적으로 조절하여 생산성, 수율, 농도를 높일 수 있는 방안이 제시되었다.
가) CBD-Cohesin 인공효소체인
그림 3(c)에 보인 것은 다수의 효소를 채널링효과가 극대화되도록 근접하게 배치하기 위하여 소위 스카폴드(scaffold)를 활용하는 기술이다. 자연계에 존재하는 셀룰로좀(cellulosome)을 모사하여, 크게 2개의 융합단백질로 구성되어 있다. 첫 번째 융합단백질인 스카폴딘 (scaffoldin)은 셀룰로스결합도메인(cellulose-binding domain, CBD)과 여러 개의 코헤신(cohesin)으로 구성되어 있어 스카폴드 역할을 하고, 두 번째 융합단백질은 각각의 효소단백질들이 서로 다른 도커린(dockerin)과 융합되어 발현된다. 발현된 두 번째 효소융합단백질들은 각각 도커린-코헤신 상호작용에 의해 첫 번째 스카폴딘 융합단백질에 순차적으로 나열되게 재구성이 가능하다. 매우 특이성(specificity)이 높은 도커린-코헤신 상호작용은 스카폴딘에 인위적으로 효소를 순차적으로 배열할 수 있는 도구를 제공하여 3개 이상의 효소단백질도 인공효소체인의 제조가 가능하게 하였다. 세포내에서 거대한 융합단백질들이 잘 발현되어 원하는 연속 효소반응이 효과적으로 촉진되어 생산성, 수율, 농도를 높이고자 하는 것이 궁극적인 목표가 된다.
나) GBD-SH3-PDZ 스카폴드 시스템
후생동물(metazoa)유래 GBD, SH3, PDZ 단백질을 융합단백질로 발현하여 스카폴드로 사용하고 이 단백질들과 결합할 수 있는 펩타이드 리간드(peptide ligand)들을 AtoB, HMGS, HMGR 효소들과 각각 융합발현시키면(그림 4), 기존 시스템에 비교하여 77배 높은 대사산물인 mevalonate를 생산할 수 있었다.
...................(계속)
* 로그인 하셔야 자세한 정보를 모두 보실 수 있습니다.
-
이전글
- 탄소자원화 광합성 세포공장 (Carbon utilizing photosynthetic cell factory)
-
다음글
- 단일 뉴런 분석기술 (Single neuron analysis)
지식
동향


 인공효소 체인.pdf
인공효소 체인.pdf
 CBD봉합체를 이용한 인공효소체인
CBD봉합체를 이용한 인공효소체인