BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공유전자치료의 현주소
- 등록일2018-10-29
- 조회수17773
- 분류레드바이오 > 의약기술
-
저자/소속
김연수 교수, 유승신 본부장/충남대학교 신약전문대학원 , 바이로메드 신사업기획본부
-
발간일
2018-10-29
-
키워드
#유전자치료
- 첨부파일
-
차트+
?
차트+ 도움말


유전자치료란 유전물질 또는 유전물질을 이입한 세포를 인체에 투여하여 질병 치료 혹은 예방의 효과를 기대하는 치료기술을 의미한다. 즉, 외부에서 정상유전자 또는 치료유전물질을 환자의 세포 안으로 도입하여 결함 유전자를 보완하거나 또는 세포에 새로운 기능을 제공함으로써 질병을 치료 및 예방할 수 있는 기술을 총칭한다.
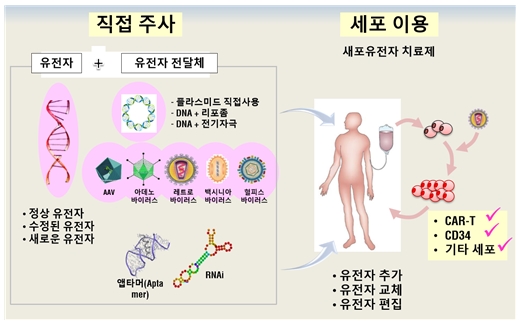
[그림 1. 유전자치료제의 개념. 유전물질을 직접 인체에 전달하는 in vivo 유전자치료와 유전물질이 도입된 세포를 인체로 주입하는 ex vivo 세포유전자치료로 분류됨]
2012년부터 유럽과 미국에서 품목허가를 받기 시작한 유전자치료제가 작년(2017년), 미국에서 3종의 유전자치료제(2종의 혈액암 유전자치료제 및 1종의 실명 유전자치료제)가 FDA로부터 품목허가를 받고, 연이어 올해(2018년) 수포성 표피박리증 유전자치료제가 희귀질환의약품으로 지정 받으면서, 사이언스 과학 잡지뿐 아니라 많은 언론들이 유전자치료 시대의 도래(Gene therapy comes of ages)라는 표제의 기사를 편성하여 관심과 기대를 표명하였다. 여러 가지 의미로 올해 2018년은 유전자치료 개발 역사에서 매우 상징적인 해로 기록이 될 것으로 생각된다.

[그림 2. 임상3상을 거쳐 미국과 유럽에서 품목허가를 획득한 유전자치료제]
미국 NIH/FDA의 유전자치료 임상시험 리뷰프로세스의 단일화의 의미
유전자치료 연구와 개발이 가장 앞서 있는 미국의 경우, 1990년 선천성면역결핍증 유전자치료 임상시험부터 시작하여 지금에 이르기까지 유전자치료 임상프로토콜에 대한 리뷰를 위해 FDA뿐 아니라 NIH에서 운영하고 있는 RAC (Recombinant DNA Advisory Committee)에도 자료를 제출하도록 요구하고 리뷰를 진행하였다. 유전자치료 임상시험 프로토콜 내용을 과학적이고 윤리적인 관점에서 그 안전성과 효용성을 점검하기 위한 조치였으며, 데이터와 경험의 축적으로 RAC에서의 리뷰를 면제해주는 임상프로토콜도 확대되어왔다. 그러나 30년에 가까운 유전자치료 임상시험의 데이터와 과학적 증거들을 종합하여 고려할 때 더 이상 유전자치료제를 다른 종류의 의약품들과 별개의 review track을 운영하며 안전성과 윤리성을 고려해야할 이유가 없다고 판단하여, 2018년 8월 NIH Director(Dr. Francis Collins)와 FDA Commisioner(Dr. Scott Cottlieb)는 협의를 통해 유전자치료제 임상시험 허가를 위한 리뷰를 RAC에서 진행하지 않고, 다른 의약품과 마찬가지로 FDA의 리뷰만을 진행하도록 가이드라인을 변경고시 하였다. 이러한 미국 NIH의 전향적인 조치가 의미하는 것은 무엇일까? 물론 아직 100% 속단하기는 이르지만, 유전자치료제도 이제는 다른 의약품들과 크게 다르지 않게 FDA에서 운영하는 안전성 및 유효성 검토프로세스만으로 품목허가가 가능한 표준의약품으로서의 신뢰를 확보한 것이라고 할 수 있을 것이다.

[그림 3. 유전자치료 임상시험 사전검토 가이드라인 폐지를 공지하는 NIH 홈페이지 (https://osp.od.nih.gov/biotechnology/nih-guidelines/)]
그 동안 유전자치료 기술은 윤리, 도덕, 안전성 문제에 대한 많은 비판과 우려의 대상이었기에 글로벌 대형 제약회사의 외면을 받으며 소수의 연구자와 작은 규모의 스타트업 바이오기업에서 개발을 주도해왔다(불과 5~6년 전부터 대형 글로벌제약사들이 기술도입과 합병을 통해 유전자치료제 개발에 투자하기 시작하였음). 유전자치료를 바라보는 불신과 우려에서 벗어나기 위해, 이 분야의 연구자들은 안전성(safety)과 효용성(efficacy)을 확보할 수 있는 바이러스벡터의 개발을 위한 기초연구에 많은 노력을 기울이며 인내(persistence)한 결과, 지금부터 50년(반세기) 전인 1968년에 바이러스를 이용한 유전자 전달에 대한 논문이 Nature에 게재되면서 개념과 가능성이 탄생되었던 유전자치료기술의 길고 험한 개발 여정을 헤쳐 나왔고, 정확히 반세기가 지난 오늘 날 난치성 질병 치료의 대표적 미래치료기술로 인정받게 된 것이다.
유전자치료기술은 분야 그 자체가 혁신적 기술이다. 2013년 5월 삼성경제연구소가 발간한 「미래산업을 바꿀 7대 파괴적 혁신기술」 보고서에는 유전자 치료제가 “10년 내 실현 가능성이 큰 7대 혁신기술 중 하나”로 선정되었고, 2014년 5월 MIT 테크놀로지리뷰는 유전자 편집기술(Genome Editing) 기반 유전자치료 기술을 올해(2014년)의 혁신 기술 10가지 중 하나로 선정하고, 수년간 기술 발전을 통해 문제 해결에 있어 종전과는 완전히 다른 창의적인 방식이라고 평가하였다. 다시 말해 유전자치료기술은 성공을 위해 융·복합, 다학제 연구가 필수적인 혁신적 분야로 평가받아왔다. 그리고 5년이 채 지나지 않아 그 기대를 충족시켜주며 차세대 바이오의약 대표기술 중 하나로 자리매김하게 되었다.
그러면 현재 개발되고 있는 유전자치료제들이 안전성과 유효성을 확보하는데 어떠한 기술들의 발전이 기여했는지, 그리고 앞으로 기술발전의 예상과 또한 극복해야할 문제들은 무엇이 있는지 살펴보고자 한다.
바이러스를 활용한 유전자전달체 (Viral vectors)
1980년 노벨상 수상은 현대 생물학 발전사에 이정표가 되는 수상 발표로 평가되고 있다. 게놈 프로젝트와 유전자치료, 그리고 2016년 4차 산업혁명에서 언급된 합성생물학 기술의 가능성을 잉태하게 하였던 DNA 염기서열 시퀀싱 방법(생거 박사와 길버트 박사)과 재조합 DNA 기술을 진핵세포를 대상으로 실현(폴 버그 박사)시킨 공로로 3명의 과학자가 공동수상 하였다. 이 기술들은 생명현상의 본질인 유전물질의 정보의 해독을 가능하게 하였고, 더 나아가 유전물질의 재조합을 통해 생명을 조작하는 일을 가능하게 한 기술로 평가된다. 여기에 인체 세포 내로 유전자를 전달할 수 있는 바이러스 벡터들이 개발되면서 유전자치료의 실현 가능성이 폴 버그박사의 노벨상 수상연설에서 언급되었다. 이중 레트로바이러스벡터(retroviral vector)와 adeno-associated virus (AAV) 벡터가 심각한 부작용이 없는 효과적인 유전자전달 효율에 기반하여 지금까지의 유전자치료 임상적용에서 광범위하며 우수한(promising) 치료효과를 보여주고 있다. 여기에 최근 유전체 편집기술(genome editing)도 유전자치료에 일부로 도입되면서 유전체 교정을 통한 질병치료도 가능하게 되었다. 실제로 가장 큰 규모의 유전자치료학회인 ASGCT(미국유전자세포치료학회)에서 발표되는 최근의 연구결과를 분석하였을 때 상기 3가지 기술을 사용하는 연구개발이 주류를 이루고 있다는 사실을 알 수 있다.
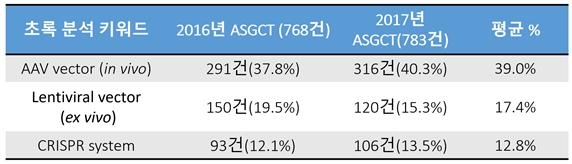
[그림 4. 미국 유전자세포치료학회 발표초록 키워드 분석을 통한 주요기술 조사]
또한 현 시점에서 많은 전문가들이 위 두 종류의 바이러스벡터에 기반한 유전자 전달기술을 현재 유전자치료 기술의 성공요인으로 꼽고 있으며 유전체 편집기술과의 융합을 미래 유전자치료 기술에 대한 기대요인으로 평가하고 있다.
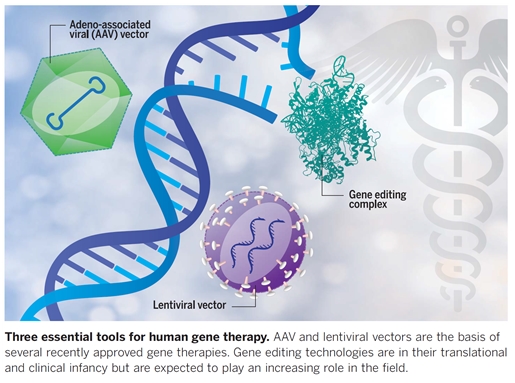
[그림 5. 유전자치료의 핵심 기술도구 Dunbar et al., Science 359, 175 (2018)]
Retroviral vectors (γ-retroviral vector and lentiviral vector)
하워드 테민 박사의 연구로 역전사(reverse transcription)를 수반하는 레트로바이러스의 life cycle이 규명되고 유전물질(retroviral genome)에 대한 정보가 밝혀지면서 1980년대에 분열하는 세포에만 감염할 수 있는 γ-retroviral vector가 개발되었고, 1990년대에 들어와서는 인간 T 세포와 조혈모세포에 유전자를 전달하는 연구가 진행되었다. 이렇게 개발된 벡터는 인체를 대상으로 한 첫 번째(1990년) 유전자치료 임상시험인 선천성 면역결핍증 치료와 더불어 1세대 항암 CAR-T 임상시험에도 사용되었다. 그러나 γ-retroviral vector는 분열하지 않는 대부분의 인체세포로는 유전자전달이 불가능하다는 제한과 염색체 삽입 후 전달유전자 발현의 침묵현상(gene silencing) 및 insertional mutagenesis의 위험성을 내포하고 있어 이를 해결할 수 있는 방법이 필요하였다.
다행히 레트로바이러스의 일종인 렌티바이러스(lentivirus)의 경우는 γ-retroviral vector와 달리 세포분열과 관계없이 유전자전달이 가능하며 삽입되는 염색체의 위치가 비교적 oncogenic insertional mutagenesis의 위험성이 낮은 곳에 분포하고 비교적 용이하게 SIN (self-inactivating) design을 도입하여 oncogenic insertional mutagenesis의 위험성을 원천적으로 차단할 수 있어 현재 ex vivo 유전자치료를 위한 가장 각광받는 유전자 전달 벡터로 자리매김하고 있다. ex vivo 유전자치료란 유전물질을 유전자전달 벡터를 사용하여 먼저 세포에 도입한 후, 그 세포들을 인체로 주입하는 유전자치료 방법을 말한다. 현재 진행되고 있는 대표적인 ex vivo 유전자치료를 위해서 사용되는 세포는 크게 T 세포와 조혈모세포(HSPC)로 나누어진다. T 세포는 주로 암을 치료하기 위한 CAR-T (chymeric antigen receptor-T cell) therapy에 이용이 되며, 조혈모세포는 다양한 유전, 대사, 감염질환 및 퇴행성질환의 치료를 위한 유전자치료에 사용되고 있다.
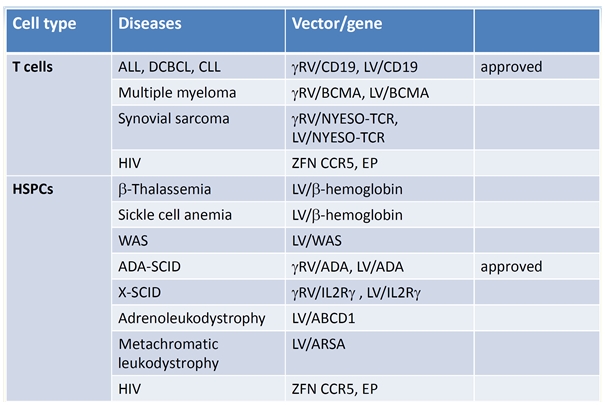
[그림 6. Clinical and product development landmarks for ex vivo gene therapies. gRV, murine g-retrovirus; LV, lentivirus; ALL, acute lymphoblastic leukemia; CLL, chronic lymphocytic leukemia; HSPC, hematopoietic stem and progenitor cells; X-SCID, X-linked severe combined immunodeficiency; ZFN, zinc finger nuclease; BCMA, B cell maturation antigen; ARSA, arylsulfatase A; ABCD1, transporter gene mutated in adrenoleukodystrophy. (modified by from Dunbar et al., Science 359, 175)]
그림 6에 표시된 유전자치료제 중에서도 이미 3종류가 품목허가를 받았으며(2016년 ADA-SCID 유전자치료제, 2017년 2건의 CAR-T 유전자치료제), 나머지 치료제들도 임상에서 매우 우수한 치료효과를 보여주어 품목허가의 가능성을 보여주었다. 특히 ADA-SCID (선천성 면역결핍증의 일종) 유전자치료제의 경우 임상시험 및 품목허가 후 치료받은 모든 환자가 완치되는 놀라운 치료효과를 보여주었으며, 두 종류의 혈액암 CAR-T 유전자치료제 또한 80% 내외의 완치율을 나타내고 있다. 이러한 CAR-T의 예상을 뛰어넘는 혈액암 치료효과에 고무된 많은 연구자와 제약회사들이 다양한 고형암들과 감염성 질환을 타겟으로 하는 CAR-T 개발에 착수 하였으며, T 세포를 넘어 NK 세포를 대상으로 한 항암 유전자치료제 CAR-NK의 개발도 진행하고 있다.
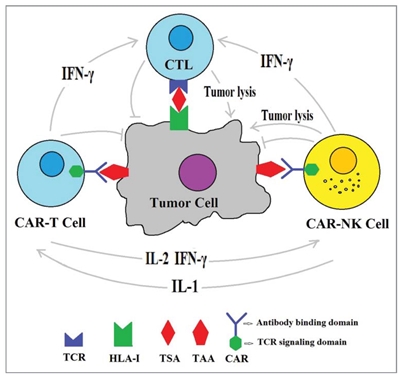
[그림 7. Combinational CAR-T plus CAR-NK cell therapy hypothesis: The CAR-T, CAR-NK and CTL are simultaneously induced to exert synergistic anti-tumor activity. (HUMAN VACCINES & IMMUNOTHERAPEUTICS 2017, VOL. 13, NO. 8, 1786)]
최근에는 렌티바이러스벡터를 이용하여 다양한 치료유전자를 성체줄기세포(mesenchymal stromal cells)에 도입한 후 인체에 주입하는 ex vivo 유전자치료 연구도 활발히 진행되고 있으며, 기존에 난치성 질환이라고 여겨졌던 많은 질환들의 치료에도 좋은 결과를 기대할 수 있는 연구결과들이 지속적으로 보고되고 있다.
Adeno-associated viral (AAV) vectors
1990년대 중반에 두 연구그룹이 독립적으로 AAV 벡터를 mouse 근육에 주입하여 도입된 유전자의 장기간 발현을 보고한 이래 비약적인 기술적 진보를 이루어내며 현재 유전자치료제 개발의 가장 중요한 벡터시스템으로 자리 잡게 되었다. 개발 초기에는 helper virus(아데노바이러스 또는 허피스바이러스)를 사용해야하는 번거로움과 제거방법의 어려움 이외에도 높은 역가(titer)의 바이러스벡터를 생산하기도 어려웠으며 분리정제도 다른 바이러스벡터에 비해 많은 노동력과 비용이 소요되어 널리 사용되지는 못하였다. 그러나 다양한 생체 장기로의 높은 감염효율과 전달된 유전자의 장기간 발현이라는 버릴 수 없는 장점을 활용하기 위하여 오랜 기간 많은 연구자들에 의하여 개발이 진행되어 현재는 많은 유전성 및 퇴행성 질환의 치료를 위한 in vivo 유전자치료의 핵심 유전자전달벡터로 각광받고 있다.
AAV는 자연적으로 capsid 단백질 아미노산 서열에 따라 다양한 혈청형으로 구분되며, 혈청형에 따라 다양한 장기조직으로의 높은 특이적 감염효율을 보인다. 여기에 DNA suffling을 비롯한 다양한 기법으로 capsid 단백질 아미노산의 변화를 유도하여 타겟 조직으로의 감염효율과 특이성을 극대화 시키는 전략의 적용도 가능하여 계속적으로 벡터시스템의 최적화와 진화가 이루어지고 있다.
...................(계속)
* 로그인 하셔야 자세한 정보를 모두 보실 수 있습니다.
지식
동향


 국내외 유전자치료의 현주소.pdf
국내외 유전자치료의 현주소.pdf
 유전자치료제의 개념
유전자치료제의 개념