제도동향
유전자치료제 개발 및 규제동향 2018
- 등록일2019-01-07
- 조회수12691
- 분류제도동향 > 종합 > 종합
-
자료발간일
2018-12-28
-
출처
식품의약품안전평가원
- 원문링크
-
키워드
#유전자치료제
- 첨부파일
유전자치료제 개발 및 규제동향 2018
목차
1. 서론
2. 유전자치료제 개요 및 개발 현황
2.1. 유전자치료제 개요
2.2. 바이러스성 유전자치료제 개발 현황
2.3. 비바이러스성 유전자치료제 개발 현황
3. 유전자치료제 관련 규제 동향
3.1. 유전자치료제 안전성 관련 규제 동향
3.2. 한국의 유전자치료제 규제 동향
3.3 미국의 유전자치료제 규제 동향
4. 유전자치료제 안전성 관련 연구 동향
4.1. 바이러스성 쉐딩 (Viral Shedding) 연구 동향
4.2. 생식선 전이 (Germline Transmission) 연구 동향
4.3. 제1형 단순포진바이러스(HSV-1) 기반 유전자치료제의 비임상 안전성 평가 연구 동향
5. 유전자치료제 역가시험법 개발 동향
5.1. 유전자치료제 역가시험법 개요
5.2. 비바이러스성 유전자치료제 역가시험법 개발 동향
6. 맺음말
7. 참고문헌
1. 서론
“유전자치료제”란 ‘유전물질 발현에 영향을 주기 위하여 투여하는 유전물질’ 또는 ‘유전물질이 변형되거나 도입된 세포’ 중 어느 하나를 함유한 의약품을 말한다.
유전자치료제는 현재 치료법이 없는 희귀·유전 질환이나 기본 치료법에 대한 미충족 수요(unmet needs)가 높은 퇴행성·난치성 질환에 대하여 치료를 가능케 할 것으로 기대되고 있다. 또한 근본적 치료를 가능케 하므로 질병 완치의 가능성 제공과 함께 높은 시장 잠재력을 보유하고 있어, 기존 바이오의약품 시장을 주도했던 2세대 항체 치료제를 넘어설 제약시장의 블루칩으로 부상하고 있다.
2012년 7월, 유럽연합(EU)은 선진국 최초로 유전자 치료제인 유니큐어(UniQure)의 ‘글리베라(Glybera)’를 허가했고, 2015년 미국식품의약국(FDA)은 항암 유전자치료제인 Amgen의 ‘임리직(Imlygic)’을 허가했다. 이 후로 유전자치료제는 상당한 부가가치를 창출할 수 있는 차세대 첨단기술로서 인정받아, 선진국을 비롯하여 전 세계적으로 활발하게 개발되고있다.
상용화 측면에서 볼 때, 풍부한 다국가 임상 데이터와 시장성이 유망한 다수 치료제들의 개발로 인해 유전자치료제에 대한 기대와 시장의 관심은 계속 커지고 있는 상황이다. (그림1,2.3.)
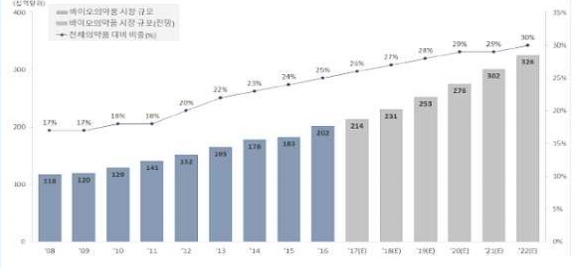
그림 1. 글로벌 바이오의약품 시장규모 및 전망(‘08 ∼ ’22 년)
(출처: ttp://www.emedico.co.kr/news/articleView.html?idxno=43899)

그림 2. 지역별 유전자치료제 글로벌 마켓 예상 매출 추이
(출처: https://tokenfolks.com/new-report-provides-2011-2018-overview-of-global-gene-therapy-sales-market/)
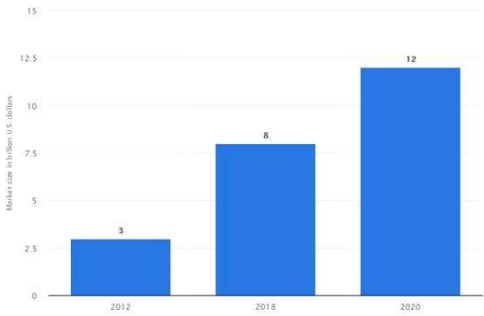
그림 3. 유전자치료제 및 세포치료제의 글로벌 마켓 예측(‘12 ∼ ’20 년)
(출처: https://www.statista.com/statistics/687229/global-cell-and-gene-therapy-market-size/)
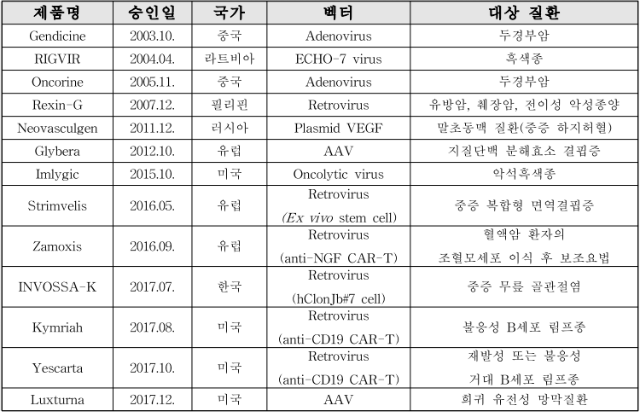
현재까지 허가된 국내외 유전자치료제 허가 현황은 다음 표 1과 같으며, 특히 국내 첫 유전자치료제로 2017년 식품의약품안전처로부터 국내 시판허가를 받은 세계 최초 무릎 골관절염 유전자치료제로 인보사케이주(코오롱생명과학)가 있다. 이 외에도 바이로메드, 진원생명과학, 녹십자, 동아제약, 제넥신, 신라젠, 대웅제약, 이연제약 등이 유전자치료제를 개발하고 있으며, 이들의 해외 임상 승인, 기술 수출 등 연구개발 성과가 가시화되면서 국내 유전자 치료제의 해외 진출에 대한 기대가 높아지고 있다.
표 1. 국내외 유전자치료제 허가 현황
이에, 본 보고서에서는 2017-2018년에 식품의약품안전처에서 수행한 「유전자치료제 심사평가 기반 연구 (한국화학연구원 부설 안전성평가연구소, 문경식)」결과를 토대로 국내외 유전자치료제 개발기술 현황 및 규제동향에 대하여 소개하고자 한다. 이 보고서는 바이러스성 유전자치료제로 HSV-1과 같은 종양용해성 바이러스와 CAR-T 등의 개발에 사용되는 렌티바이러스에 기반한 유전자치료제, 비바이러스성 유전자치료제로 전기천공법 기반 플라스미드 유전자치료제에 대하여 한정적으로 그 내용을 소개한다. 이러한 자료들이 유전자치료제 개발 및 허가·심사의 기초자료로 활용되기를 기대한다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 유전자치료제+개발+및+규제동향+2018+(안).pdf
유전자치료제+개발+및+규제동향+2018+(안).pdf