제도동향
바이오의약품 설계기반 품질고도화(QbD) 모델 개발 안내서 제정알림
- 등록일2021-03-05
- 조회수5266
- 분류제도동향 > 종합 > 종합
-
자료발간일
2021-02-17
-
출처
식품의약품안전처
- 원문링크
-
키워드
#바이오의약#품질고도화#의약품설계
- 첨부파일
바이오의약품 설계기반 품질고도화(QbD)
모델 개발 안내서[민원인 안내서]
◈목 차
I. QbD 총론
1. QbD 방식 개발 개요
(1) QbD 도입배경
(2) QbD 접근법을 활용한 제품 개발
(3) 설계공간
(4) QbD 요소의 전주기 관리
(5) 전망
2. QbD에 대한 해외 규제기관의 현황
(1) QbD와 ICH 가이드라인
(2) FDA의 CMC 문서 심사 규정
(3) PMDA의 QbD 현황
(4) FDA의 QbD 현황
3. 바이오의약품 개발 단계별 QbD 개발 전략
4. QbD 실현을 위한 개발 시 고려사항
(1) Risk Management – 에러 (Error)와 마진 (Margin)의 이해
(2) 비교동등성과 변경관리, 설계공간
(3) QbD를 위한 시험법 개발 및 관리
II. QbD의 실행
1. QbD 실행 절차
(1) 제품 이해과정 (Product Understanding)
(2) 공정 이해과정 (Process Understanding)
2. TPP (Target Product Profile)
3. QTPP (Quality Target Product Profile)
4. CQA (Critical Quality Attributes)
(1) 품질특성의 도출
(2) 품질특성의 분류 및 위해진단
(Risk Assessment)
(3) 중요품질특성의 허용기준 설정
(Acceptance Criteria of CQAs)
5. CPP와 설계공간
(1) 공정인자 (PP) 도출
(2) 초기 공정인자 위해진단
(Initial PP Risk Assessment)
(3) 공정특성화 실험
(4) 공정인자 위해진단 개정
(Updated PP Risk Assessment)
(5) 공정인자 분류
(Parameter Classification)
6. 관리전략
(1) 관리전략 개념
(2) 의약품 개발 단계에서의 관리전략 수립
(3) QbD 내에서의 공정 밸리데이션 추진전략
(4) 관리전략 추진 결론
III. QbD 용어집 및 참고문헌
◈본문
I. QbD 총론
1 QbD 방식 개발 개요
(1) QbD 도입배경
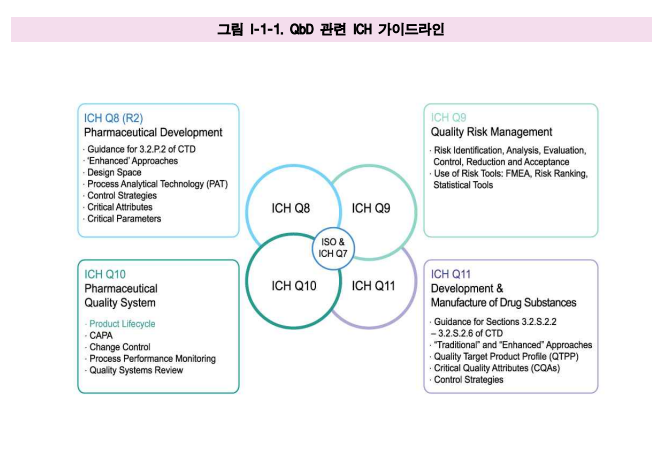
●제약산업에서 QbD 접근법의 개념은 2002년 미국 FDA가 21세기를 위한 cGMP 계획을 통해 다른 산업에서 먼저 받아들여진 최신 품질기법이 적용될 수 있도록 제시하였으며, 그 실행을 위하여
국제규제조화기관인 ICH에서 Q8 (R2), Q9, Q10, Q11 가이드라인을 발간하여 발전시켰다. (그림 I-1-1).
●또한 1987년 최초 발표된 공정 밸리데이션에 대한 FDA Guidance는 2011년 1월 QbD 접근법에서의 개념과 실행절차를 추가하면서 개정되었다. QbD 방식 개발의 원동력은 제품에 대한 더 나은 지식과 신기술 채택의 용이성, 배치 (제조단위, Batch) 실패율 감소, 제조 유연성 증가, 공정 변경에 대한 규제 감독 감소 등이며, 그 실행의
핵심은 타당한 과학적 접근과 위해관리에 기초하여 제품과 제조공정의 이해를 바탕으로 환자에게 보다 적합하도록 의약품의 품질향상을 촉진하는데 있다.
●궁극적으로 제품과 제조공정은 개발초기부터 환자의 안전과 치료에 초점을 맞추어서 개발되어야 하며, 제조공정과 제품의 품질이 그 초점의 기준에 충분히 견고하게 만족시킬 수 있어야 한다. 여기에는 최종 제품의 품질특성이 환자의 안전과 의약품의 유효성에 미치는 영향을 심도 있게
이해하는 것이 요구된다. 이에 따라 산업계를 지배해온 QbT 원칙 (Quality by Testing, 최종 제품 시험으로 사전 정의된 규격 충족을 통해 품질 보장)을 지양하고, QbD (Quality by Design, 제품의 요구 품질을 일관되게 제공하는 공정 설계) 도입을 고려하게 되었다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
지식
동향


 1.+바이오의약품+설계기반+품질고도화(QbD)+모델+개발+안내서[민...
1.+바이오의약품+설계기반+품질고도화(QbD)+모델+개발+안내서[민...