제도동향
2021년 유럽의약품감독국(EMA) 승인 현황
- 등록일2022-04-13
- 조회수4579
- 분류제도동향 > 종합 > 종합
-
자료발간일
2022-03-15
-
출처
국가신약개발재단
- 원문링크
-
키워드
#국가신약개발재단#유럽의약품감독국#EMA
- 첨부파일
2021년 유럽의약품감독국(EMA) 승인 현황
◈목차
Overview
2021년 EMA 승인 권고 의약품_적응증별
2021년 EMA 승인 권고 주요 의약품
2021년 EMA 승인 권고 Priority medicines (PRIME) 의약품
2021년 EMA 승인 거부 권고 의약품
2021년 EMA 승인 철회 의약품
2021년 EMA 승인 권고 코로나 백신/치료제
2021년 EMA 승인 권고를 받은 새로운 유효성분 (new active substance)의 신약리스트
2021년 EMA 승인 권고를 받았지만, 새로운 유효성분은 아닌 신약리스트
◈본문
Overview
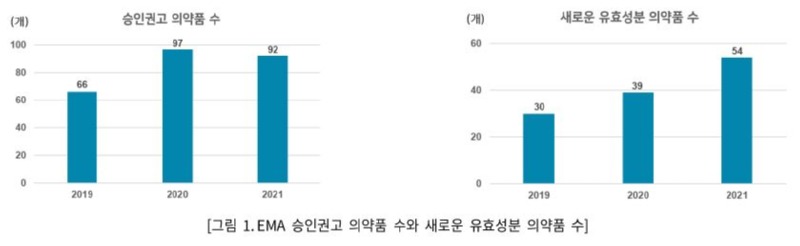
지난달 유럽 의약품감독국(EMA)는 '2021 Human Medicine Highlights'를 통해, 2021년 한 해 동안 진행한 심사결과를 공개하였다. 2021년 EMA가 판매 승인을 권고하는 긍정적인 의견(positive opinion)을 낸 의약품은 총 92개로, 전년도(97)에 비하여 소폭 감소하였다. 이 중 54개는 새로운 유효성분(new active substance)으로, 이는 이전까지 EU 회원국에서 판매 승인 권고를 받지 않은 성분의 약물이다. 승인 권고를 받은 새로운 유효성분은 2019년(30개), 2020년(39개)에 이어 최근 계속 증가하는 추세인 반면, EMA의 긍정적인 의견을 받은 개량신약 및 바이오시밀러는 2019년(41개), 2020년(36개)에 이어 2021년에는 21개를 기록하며 계속 줄어들고 있다.
2021년 EMA의 승인권고를 받은 희귀질환 의약품(Orphan Drug) 총 19개로, 전체 승인권고 의약품의 21%를 차지하였는데, 이는 전년도(총 21개, 전체 승인권고 의약품의 23%)와 비교하여 소폭 감소한 수치였다. 작년 가속심사가 이루어진 의약품은 3개였고, 조건부 승인이 13개, 비상승인은 4개였다. 새로운 적응증을 허가 받은 의약품은 89개로 2020년의 83개에 비해 소폭 증가하였다. 아래 그림을 보면 해당 의약품을 확인할 수 있다.
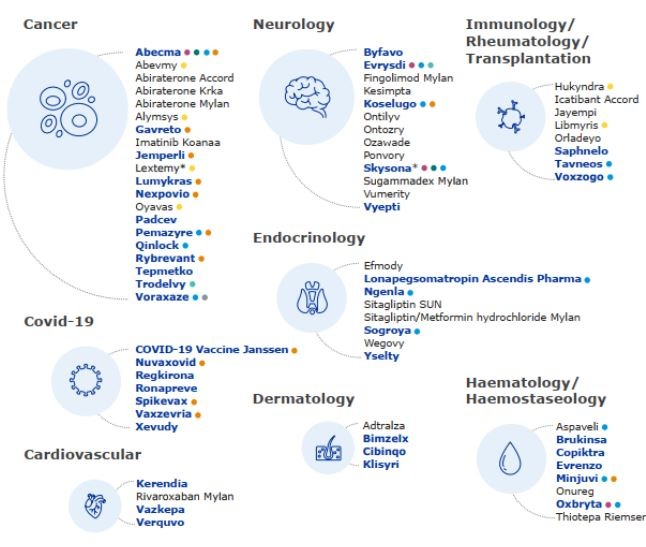

[그림2. EMA 승인권고 의약품 명단, Source: Human Medicine Highlights]
2021년 EMA 승인 권고 의약품 적응증별
EMA가 승인을 권고한 의약품의 적응증을 살펴보면, 종양군이 2020년에 이어 가장 많은 비중(22%)을 차지하였고, 이는 작년과 비슷한 수치였다. 신경계질환은 전년대비 228% 증가하며 두 번째로 많은 비중(14%)을 차지하였고, 코로나 백신/치료제와 피부질환, 안과질환 또한 전년대비 승인 권고율이 크게 증가하였다. 반면, 감염질환과 호흡기질환/알레르기질환은 전년대비 각각 81%, 71%가 감소하였다. 이는 관련 제약회사들이 최근 코로나 백신/치료제 개발에 더 집중하였기 때문인 것으로 보인다.

[그림 3. 적응증별 EMA 승인권고 의약품 분포]
2021년 EMA 승인 권고 주요의약품
지난해 EMA가 승인을 권고한 의약품들 중, '2021 Human Medicine Highlights'에서 해당 질환분야에 유의미한 발전을 가져왔다고 평가하여 주요의약품으로 선정한 신약은 다음과 같다. 총 8개의 의약품 중 7개가 희귀의약품 지정을 받았고, 4개가 First-in-Class이다.
[표 1. 2021년 EMA 승인 권고 주요의약품]
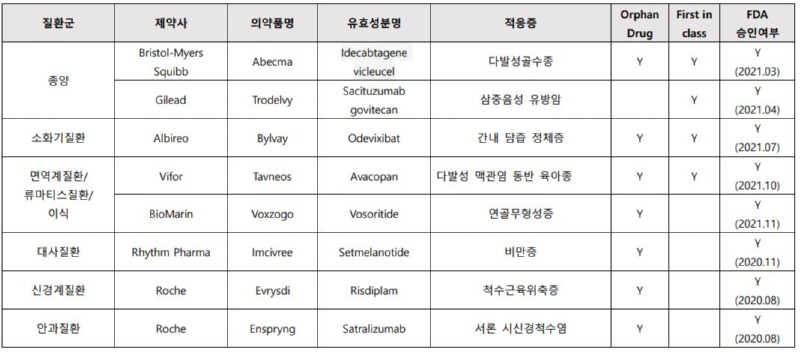
..................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보


 2021년 EMA 승인 권고 현황_KDDF.pdf
2021년 EMA 승인 권고 현황_KDDF.pdf