산업동향
몽골, 코로나19로 떠오르는 건강기능식품
- 등록일2021-08-26
- 조회수5868
- 분류산업동향 > 제품 > 바이오의약
-
자료발간일
2021-08-23
-
출처
KOTRA
- 원문링크
-
키워드
#몽골#건강기능식품
몽골, 코로나19로 떠오르는 건강기능식품
◈목차
건강기능식품 시장 규모
수입 동향
건강기능식품 시장 트렌드
수입규제 및 사전 준비사항
등록절차 및 필요서류
건강기능식품 등록 담당 기관 및 주요 수입유통업체 정보
전문가 코멘트
시사점
◈본문
건강기능식품 시장 규모
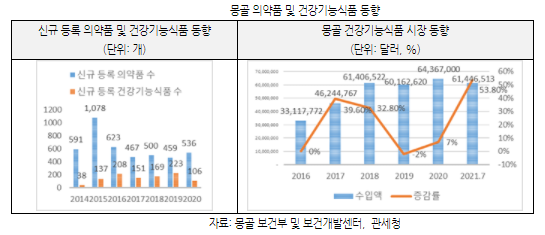
건강기능식품에 대한 몽골 소비자들의 인식이 개선되면서 최근 5개년 평균 성장률은 26%로 지속적인 증가세가 전망되고 있다. 몽골에서 의약품 및 건강기능식품 수입유통을 위해 보건부에서 제정한 ‘의약품·원료·건강기능식품 등록 규정’에 따라 등록부터 해야 수입 및 유통이 가능하다. 몽골 보건부에 의하면, 2021년 7월 기준 몽골에서 등록된 건강기능식품 수는 1114개로 확인되며, 2020년에 신규 등록된 건강기능식품 수는 106개이다. 반면 작년에 신규 등록된 의약품수는 536개로 전체 등록된 의약품 수는 4558개로 확인되고 있다.
몽골 의약품관련 사업자 협회에 의하면, 현지에서 생산되는 건강기능식품 비중이 낮아 전체 건강기능식품 시장 규모를 수입 규모로 봐야 하며, 2020년 기준 시장규모는 6436만 달러로 전년대비 7%로 증가했다. 2019년에는 마이너스 2%로 감소했으나 코로나19가 발생한 2020년에는 7%, 2021년 7월 기준 전년 동기 대비 53%로 급증세를 보이고 있다.
수입 동향
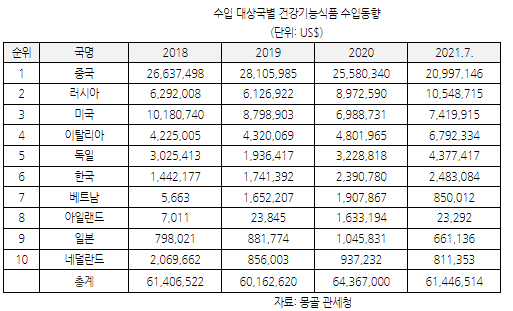
HS코드 2106.90에 해당하는 건강기능식품의 연간 수입액은 약 6000만 달러 수준이며 2019년부터 증가세를 보이고 있다. 2021년 7월 기준 현재 6144만 달러로 전년 동기 대비 53%로 급증세를 보였으며, 코로나19로 인해 현지에서 건강기능식품은 선택적으로 섭취하는 식품을 넘어 일상적으로 복용하는 제품으로 변화하고 있다.
주요 수입대상국가는 중국, 러시아, 미국, 이탈리아, 독일 등 순위로 상위 3개국이 몽골 시장의 65%를 점유하고 있다. 이 중 중국은 시장점유율 40%로 선두하고 있고 러시아는 14%로 2위, 미국은 11%로 3위를 차지하며 한국의 경우 3.7%로 6위의 자리를 잡고 있다. 상위 10개국 중 미국과 중국을 제외한 나머지 국가에서의 수입은 증가세를 유지하고 있으며, 4년 연속 성장세를 유지하고 있어 향후에도 증가 추세를 유지할 것으로 전망된다.
건강기능식품 시장 트렌드
코로나19 여파로 소비자들은 면역력 강화에 주목하기 시작했으며 건강에 대한 관심 증가로 건강기능식품 시장이 성장세를 보이고 있다. 보건부는 코로나19 발생로 자가 치료 환자들을 위해 국민에게 치료 약품을 공표했으며 비타민D와C는 필수적으로 섭취해야 한다고 발표했다. 몽골은 지리적 위치, 식생활 및 생활습관에 따라 비타민 섭취가 필요했으나 국민들은 코로나19 전염병은 비타민 부족 및 면역력이 약한 자 대상으로의 전염이 확대되는 것을 인식해 각종 비타민과 건강기능식품 섭취를 일상화하기 시작했다. 이 또한 등록된 건강기능식품 정보로 증명되고 있다. 보건부의 LICEMED시스템에 의하면, 면역력 강화에 도움이 되는 각종 멀티비타민과 C,D,Ca, B, Omega 등 다양한 비타민 등록이 증가했음을 보여주고 있다. 기존 유아와 노년층에서 주로 소비되던 건강기능식품은 코로나19 이후로 청년층, 중년층 등으로 유아부터 노년층까지 전 연령대의 소비자들로 수요가 확대되고 있다. 코로나19 예방 외에도 청년층과 중년층 소비자들은 체중조절제, 숙취해소음료 등 연령별로 다양한 제품 진출 수요가 커지고 있다.
수입규제 및 사전 준비사항
앞에서 언급한 바와 같이 건강기능식품 수입 시 우선적으로 보건개발센터에 등록해야 하며, 보건부에서 제정한 ‘의약품·원료·건강기능식품 등록 규정’으로 조정되고 있다. 몽골은 의약품·원료·건강기능식품 등록 규정을 1994년에 처음으로 제정했으며 그 이후 2002년, 2007년, 2012년, 2015년 등 5번 개정하고 최근에 2019년 6월 21일에 6번째로 등록 규정을 개정해 수입의약품과 건강기능식품에 대한 등록 조건을 강화했다. 즉, 수입 건강기능식품은 아래 5가지 조건을 충족해야 등록이 가능하다.
① 제조사가 GMP 혹은 품질관리시스템, 식품안전시스템, 식품안전관리인증(ISO 9001, ISO 22000, ISO 17025: 2018, HACCP), 해당 국가에서의 동등한 인증을 취득한 기업이어야 한다.
② 원산국에서 건강기능식품으로 분류돼야 한다.
③ 원산국에서 사용하고 있어야 한다.
④ 상품 주소 혹은 포장지에는 몽골어, 러시아어, 영어 3개 언어 중 하나로 표시해야 한다.
⑤ 사용설명서는 몽골어로 기재돼야 한다.
등록절차 및 필요서류
건강기능식품 수입 시 아래 서류를 구비해 보건개발센터에 제출해야 하며 등록은 5년 단위, 연장은 3년으로 발급하고 있다.
1. The official letter of the applicant requesting for registration of bioactive product, and conclusions on quality and safety assurance and the post-market surveillance work plan(등록 요청서, 사용 시 발생할 품질 및 안전관련 평가서, 시판 후 감시 작업 계획서)
2. Original of the application for the registration of the product in Mongolia that was certified by the authorized official of the manufacturer; signature and seal(제조업체 담당자의 서명과 도장으로 보증한 몽골에서 해당 제품등록을 요청한 신청서 원본)
3. Factory introduction (in paper and media form)(공장 소개자료/종이와 영상 형태)
4. Original of the special license certificate for importing, supplying and selling bioactive products(등록 요청업체의 건강기능식품 수입, 판매, 공급을 허용한 특별허가증 사본)
5. Certificates confirming introducing of “Good Manufacturing Practice” (GMP), or “Quality Management System”, “Food Security System”, “Food Production Hazard Analysis and Critical Control Points” (ISO 9001, ISO 22000, ISO 17025: 2018, HACCP) (certified by the manufacturer)(제조사의 GMP, ISO:9001, ISO:22000, ISO17025:2018, HACCP 등 증명서/제조업자의 인증본)
6. Documents, confirming that it is entered in the classification of “Bioactive product” in the country of origin(원산국에서 건강기능식품으로 분류돼 있음을 입증한 서류/제조업자의 인증본)
7. Export authorization of the BAP or Free Trade Certificate (certified copies of manufacturer)(동 건강기능식품의 수출허가증 혹은 자유무역 증명서/제조업자의 인증본)
8. The original test results for the final product of the manufacturer(제조사가 실행한 최종 제품의 실험실 결과서/원본)
9. The analysis results of the accredited laboratory that working under the agreement with the Office of Working Group(실무단과 계약된 공인연구소에서의 결과서)
10. Product ingredient, composition, and safety indicators, effects, adverse impacts and methods of analysis(제품 성분, 안전관련 수치, 부작용에 관한 정보와 실험 방법)
11. Description of the manufacturer’s whether genetically modified ingredients were used or not(유전자 조작 성분이 포함됐는지에 대한 제조사의 문서)
12. A description of the manufacturer about the patent of the product if the microorganism is used in the composition of the product, specifying family name and type of microorganism(제품 성분에는 미생물 포함돼 있으면 해당 미생물종류를 라틴어로 표시한 특허관련 제조사의 문서)
13. Description of the manufacturer confirming that doping is not used as an ingredient(도핑종류의 성분을 포함하지 않았다는 것을 인정한 제조사의 문서)
14. Certificate of origin of the raw material and documents of their quality and safety assurance(원료의 원산지증명서 또한 원료에 대한 품질과 안전에 관한 서류)
15. Instructions for use in Mongolian according to the approved design(몽골어 사용설명서)
16. Colored and panoramic photographs of the primary and secondary packaging and samples(1차 및 2차 포장지의 칼라 사진과 샘플)
17. Where necessary, the evidence of analysis of the external accredited laboratory and shipping payment receipt(필요 시 외부 공인연구소 시험 및 운송비 영수증)
자료: 몽골 보건부
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
다음글
- 코로나19 백신 치료제 개발 사례로 살펴본 글로벌 바이오의약품 산업 R&D 동향 및 시사점
-
이전글
- [글로벌 보건산업 동향 Vol.404] 원격의료, 견조한 성장세 유지 등 ~
관련정보
지식
동향

